基迪奥合作客户nature子刊文章发表! 返回
继去年8月在JNCI杂志发表关于circRNA翻译文章后,近日中山大学附属第一医院神经外科张弩副教授团队nature子刊又发表相关研究成果。

发表期刊:《Oncogene》
发表时间:2018
影响因子:7.519
合作单位:中山大学附属第一医院
研究背景
该研究通过circRNA测序和mRNA表达谱数据筛选了一组与神经胶质瘤显著相关的候选circRNA,并发现其中的circ-SHPRH能够编码17 kDa的SHPRH-146aa蛋白。进一步功能实验表明该蛋白能够抑制肿瘤的发展,该篇文章的发表是circRNA能够编码生物学功能蛋白的又一有力证据。
文章的亮点之一在于发现SHPRH-146aa蛋白由重叠密码子(起始和终止密码子共用一个碱基A,UGAUG)的ORF翻译而来,在真核生物中首次报道。
基迪奥参与并完成了circRNA的高通量测序和目标基因挖掘的工作,通过整合circRNA和mRNA两个RNA组学数据,缩小了筛选范围,大大地提高了目标基因的挖掘效率和准确率,为后续功能实验奠定了基础。
基迪奥具有丰富的多组学贯穿项目经验,已发表全转录组(ncRNA-mRNA,ceRNA),基因组重测序+转录组/代谢组,代谢组/蛋白组+转录组等多篇高分文章,提供丰富的多组学解决方案。
下面我们就重点了解下作者如何通过高通量和生信分析筛选目标circRNA?以及如何证明其翻译能力并进行后续研究?
研究思路

研究结果
1、circRNA-seq和特征分析
通过测序和生信分析总共鉴定到31,145个circRNA candidates,其中绝大多数是外显子型circRNA,还有部分circRNA由单一外显子形成,其它来源于内含子,基因间区和反义链(图1A)。不同染色体产生circRNA的数量也不同,本研究中1,2号染色体circRNA数量最多,Y染色体最少(图1B)。接着检索circBase数据库,可以注释6442种circRNA。
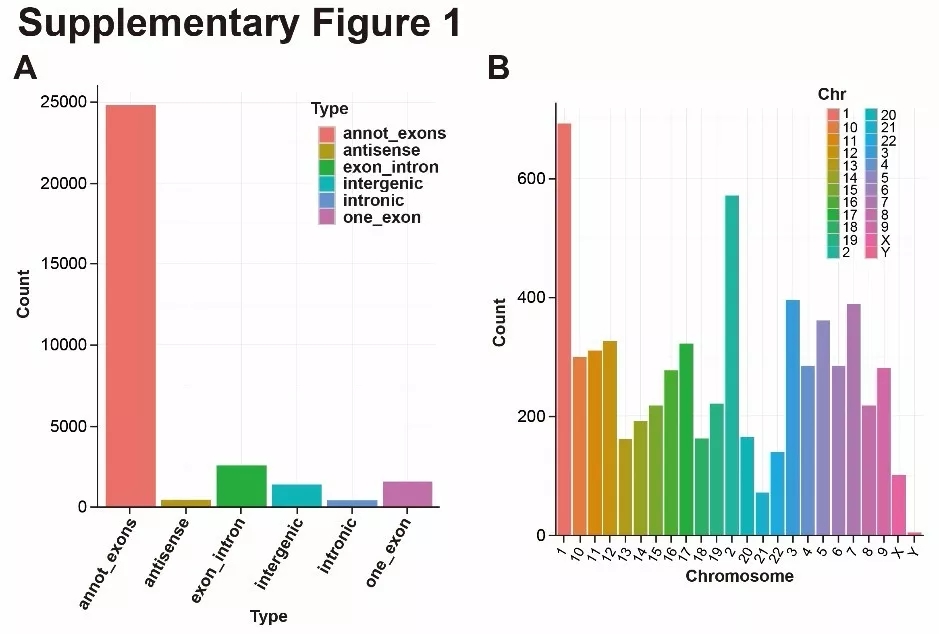
图1. circRNA类型和染色体分布
2、circRNA差异表达分析和目标分子筛选
通过组间差异表达分析,发现5498种显著差异(FDR ≤ 0.01,fold-change ≥ 2)的circRNA(2280个上调,3218个下调),对应的来源基因为3001个。接着,过滤掉低丰度的circRNA(RPM < 1),得到2709个circRNA,对应1688个来源基因。
由于作者反馈候选基因太多,无法筛选,于是基迪奥技术人员搜索NCBI芯片表达谱数据并下载分析胶质瘤和正常组织差异表达的mRNA,通过差异circRNA的来源基因和表达谱差异mRNA来协助筛选,缩小范围。最后发现了105个mRNA,注释circBase数据库后,得到41个差异circRNA,对应31个来源基因(图2)。
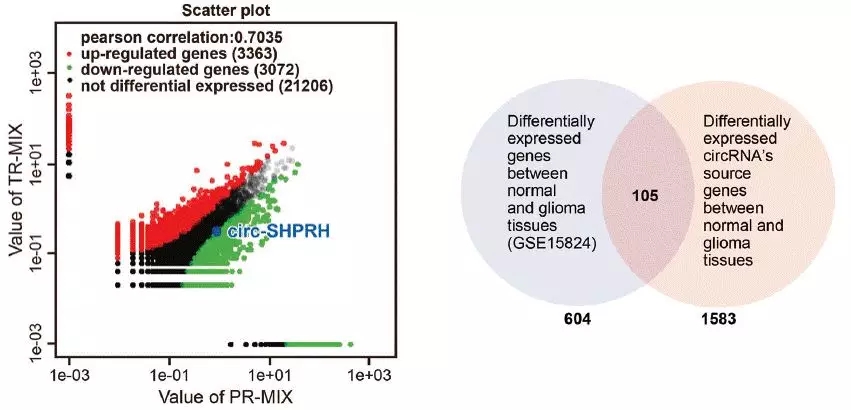
图2. 差异表达分析和多组学数据筛选
最后,作者根据来源基因的功能以及在胶质瘤中的低表达等特点,锁定目标circ-SHPRH。对其特征分析发现成熟的circ-SHPRH长度为440 nt,由其来源基因SHPRH的第26-29外显子反向拼接形成。Sanger测序证明circ-SHPRH的接口位置序列与circBase记录一致(图3)。

图3. 利用Divergent引物鉴定circRNA的接头位点
3、circ-SHPRH功能研究
设计环状表达载体和特异性的Junction探针(SH-circRNA),过表达及siRNA实验结合Northern杂交实验,在293T细胞中显著抑制和提高了circ-SHPRH表达。接着利用QPCR实验证明了circ-SHPRH在胶质瘤中显著低表达;FISH实验发现circ-SHPRH主要定位于细胞质中。
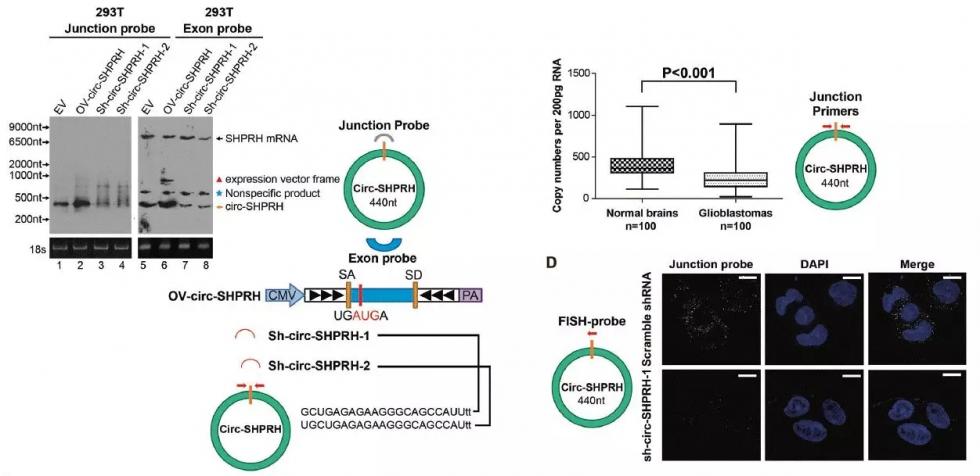
图4. circRNA功能实验
4、circ-SHPRH翻译元件分析
circ-SHPRH能够注释到circRNADb,含有ORF和IRES元件的特征,预测ORF编码一条146个氨基酸的多肽;此外,作者还发现该ORF起始和终止密码子共用一个碱基A,出现重叠密码子的现象。
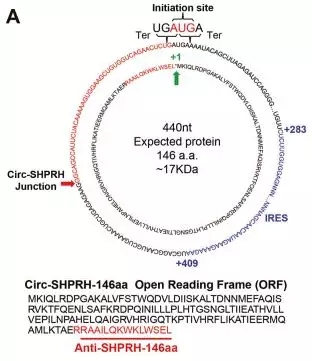
图5. circ-SHPRH的翻译元件和编码蛋白预测
为了研究翻译元件的功能,作者首先通过比对分析发现circ-SHPRH的ORF在多个物种中高度保守。
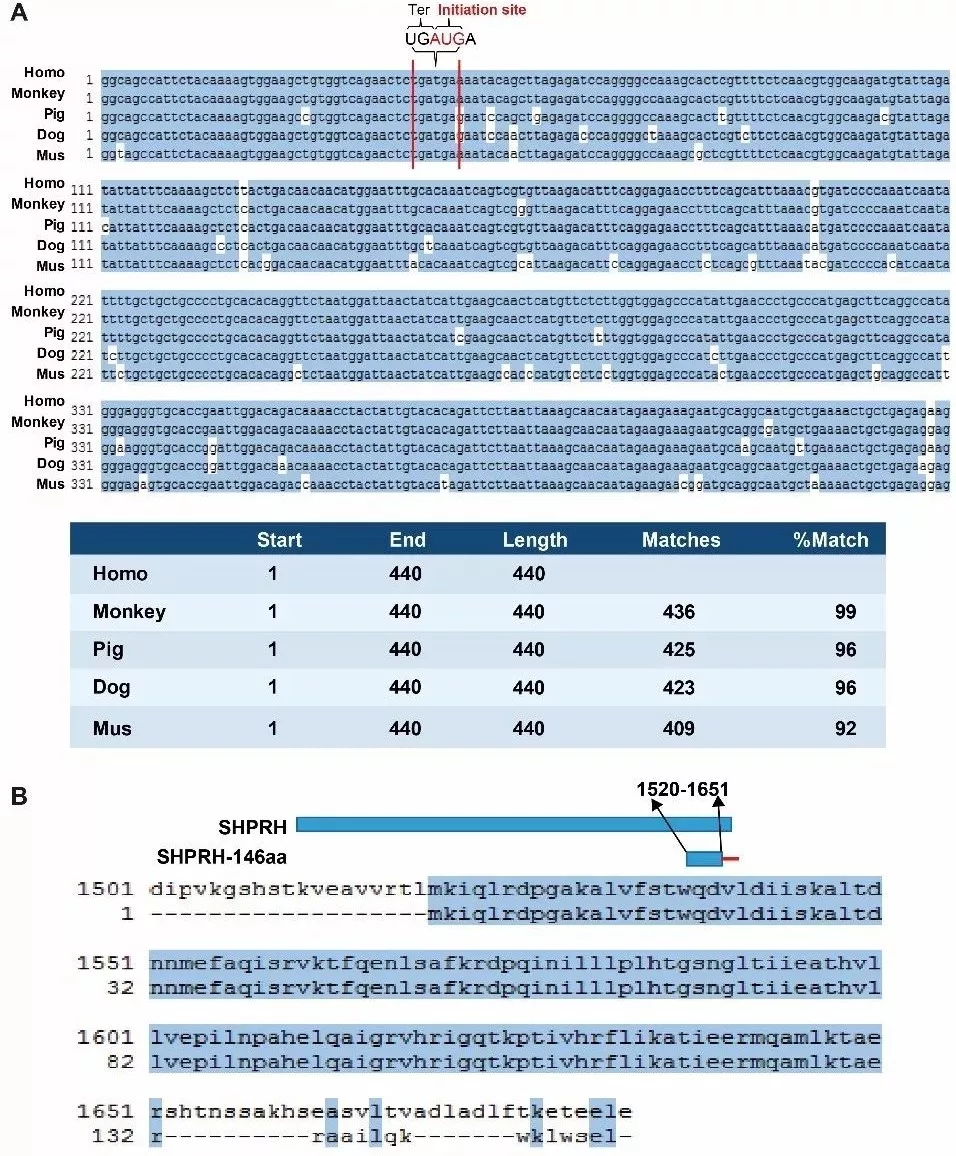
图6. circ-SHPRH的ORF保守性分析
其次,作者通过报告基因实验,比较野生型IRES和突变IRES的活性,结果显示突变IRES的活性显著降低,说明野生型IRES具有较高的活性,可能引导翻译(图7)。
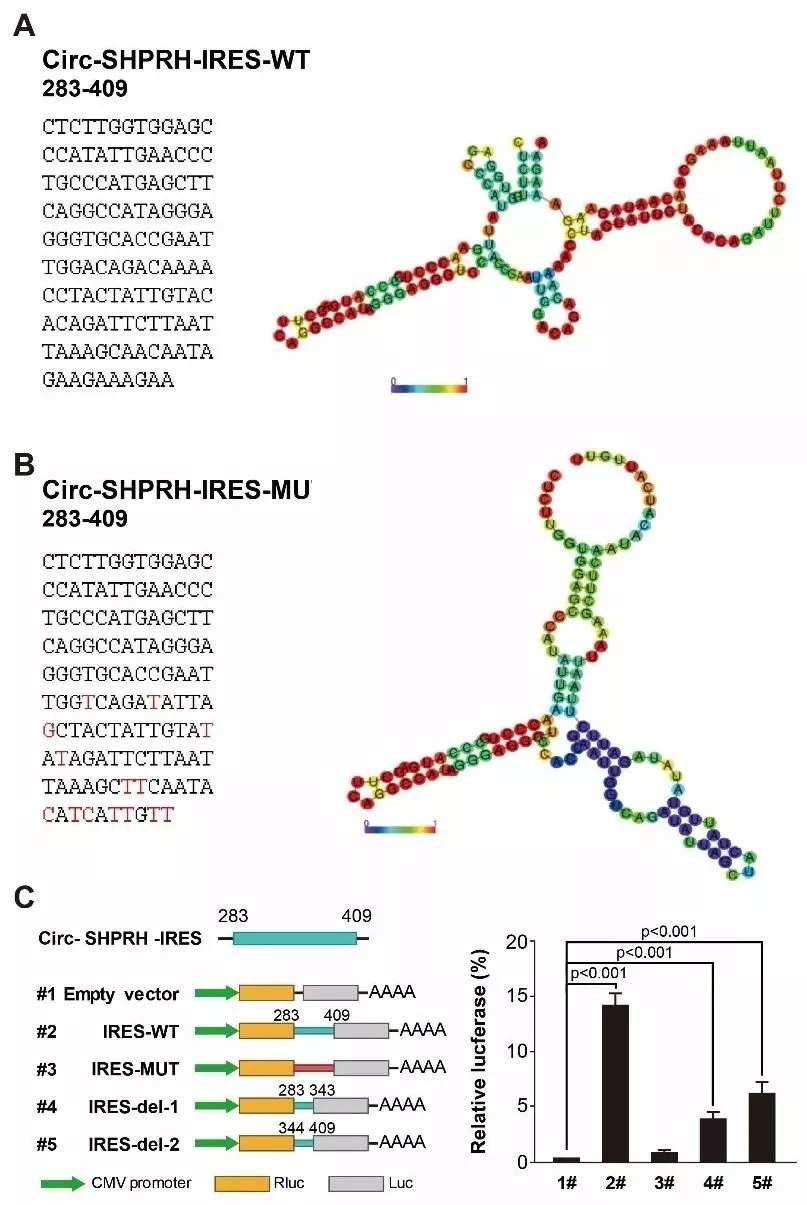
图7. circ-SHPRH的IRES活性检测
5、翻译蛋白的实验验证
作者构建circ-SHPRH过表达载体,通过特异性引物检测到在细胞中显著上调circ-SHPRH的表达;此外,设计特异性抗体Anti-SHPRH-146aa,Westernblot检测到体外细胞蛋白的过表达。
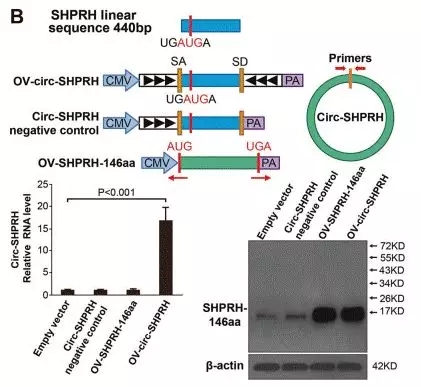
图8. circ-SHPRH过表达载体和体外蛋白表达
为了进一步证明SHPRH-146aa由circ-SHPRH翻译,作者利用LC-MS/MS质谱技术检测到内源性目的蛋白,质谱结果显示17KD的肽段覆盖了58%的SHPRH-146aa,并且包含一个环状RNA特异性junction肽段“AAILQKWK”。
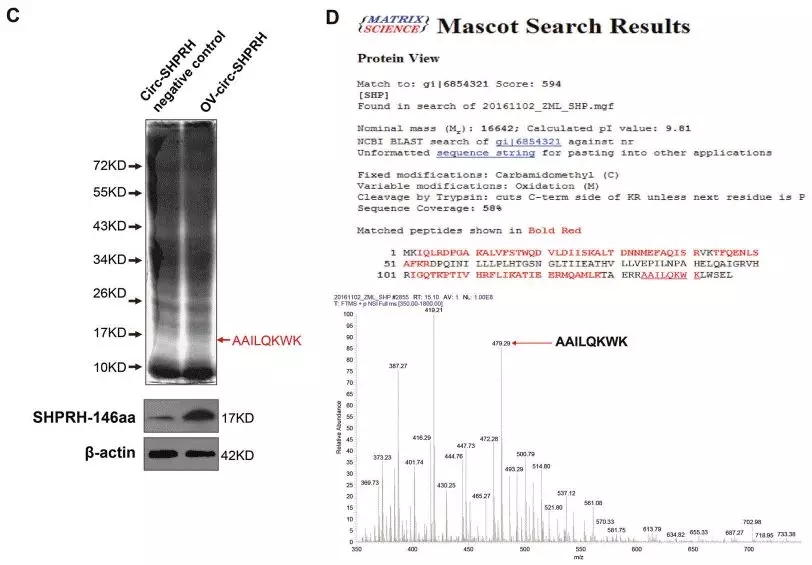
图9. 质谱检测内源性目的蛋白
因此,通过上述体外和体内实验有力地证明了circ-SHPRH翻译了环状RNA特有的蛋白SHPRH-146aa。
6、SHPRH-146aa的生物学机制研究
根据前人报道,全长SHPRH蛋白能够能特异性介导PCNA的泛素化降解,而DTL会竞争性结合全长SHPRH促使其降解,从而引发癌症。
作者通过一系列过表达,敲低实验,显示SHPRH-146aa与PCNA蛋白也存在一定关系,因此推测SHPRH-146aa与全长SHPRH类似,也对蛋白泛素化作用通路有影响。
同时发现敲低circRNA后只对PCNA和全长SHPRH蛋白有影响,而mRNA水平没有明显变化,暗示生物学机制发生在蛋白层面,而非RNA层面。
接着进行放线菌酮(CHX)半衰期和CoIP等实验,发现SHPRH-146aa能够结合DTL,并稳定全长SHPRH蛋白,从而实现对PCNA蛋白的降解,降低肿瘤的发生。
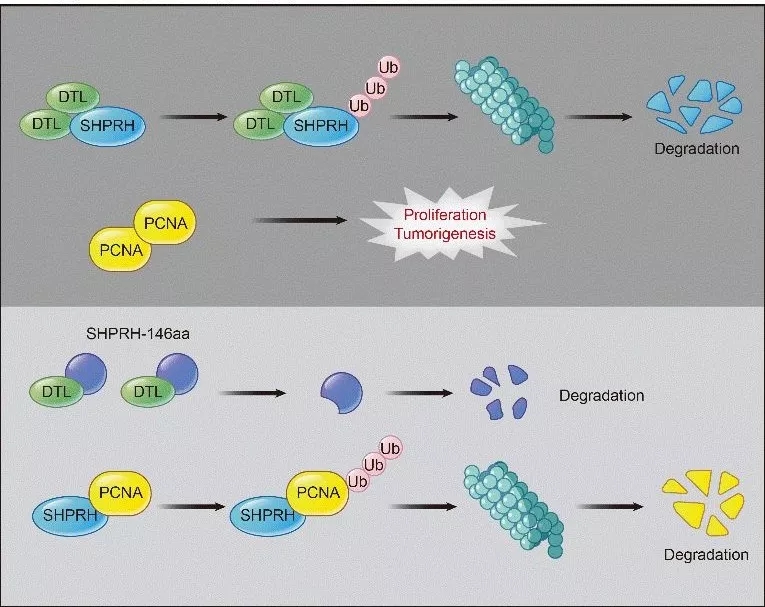
图10. SHPRH-146aa的生物学机制
7、SHPRH-146aa预后分析,细胞学和动物模型分析
为了进一步探讨SHPRH-146aa蛋白的临床应用,作者利用 western blot研究了60例胶质瘤和相邻正常组织中SHPRH-146aa的表达水平,结果显示胶质瘤中表达显著低于正常组织。细胞增值和小鼠成瘤实验也证明SHPRH-146aa对肿瘤细胞有明显的抑制作用(图11C, D)。
生存分析表明高表达SHPRH-146aa或者全长SHPRH蛋白的病人预后生成率更高(图11A),说明SHPRH-146aa能够作为预后标记物。
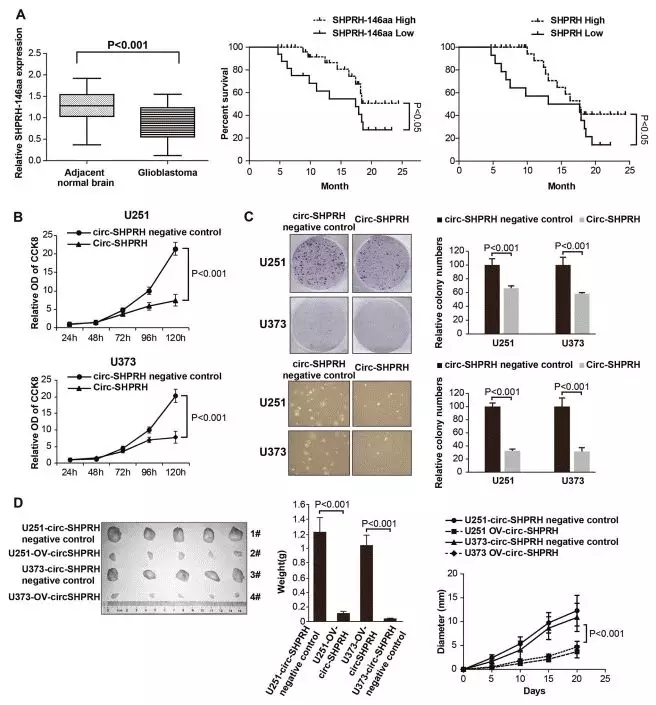
图11. 预后分析和动物模型实验
小 结
1. 本文首次发现真核生物circRNA拥有重叠密码子(起始和终止密码子共用一个碱基A,UGAUG)的ORF,在生物体内翻译出功能性蛋白SHPRH-146aa。该现象此前只在病毒circRNA中被报道过,这种特殊的ORF序列形式也更加丰富了circRNA的研究内容;
2. circRNA测序得到的差异基因往往较多,本文巧妙利用来源基因与表达谱数据进行整合分析,从而大大缩小了目标circRNA的筛选范围;
3. 通过circ-SHPRH的来源基因和全长SHPRH蛋白来推测circRNA和其蛋白的功能已经在多个文章中得到验证,这也说明了来源基因对circRNA的重大影响,因此可以作为筛选目标circRNA的指标之一。
更多的原创文章,可继续关注我们网站动态发布,同时关注基迪奥微信~扫一扫添加基迪奥好友~随时随地关注行业动态!