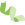
如何利用多组学进行小肽的研究? 返回
依据中心法则,生物体从基因组到蛋白质组主要经历了RNA生成调控(表观调控和转录调控)、RNA降解调控、蛋白质生成调控(翻译调控)、蛋白质降解调控这四个调控阶段。其中,翻译调控占所有调控比例的一半以上,超过其他所有调控的总和,是细胞内最重要的调控方式。因此,对基因组中遗传编码能力的研究是生物学的重点和难点。
最近,通过组学技术和生物信息学发现生物体含有大量小编码序列smORFs或sORFs(< 100 amino acid)能够编码小肽(SEPs)(图1),从而为我们揭示了生物体遗传编码的复杂性。同时,经典的预测基因编码能力的生信软件和算法主要针对长的编码序列,往往会忽略到smORFs。此外,smORFs也能够以non-AUG非经典起始密码子开启翻译,这也带来了新的研究难点和挑战。
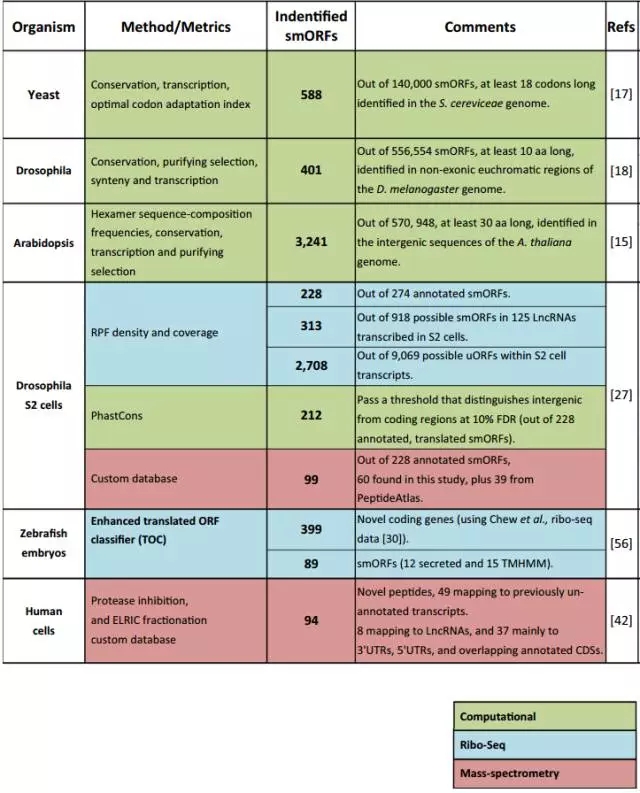
图1. 利用生物信息学、转录组学、蛋白组学和翻译组学在相关物种中发现smORFs和SEPs
目前,通过生物信息学预测、转录组学、蛋白组学和翻译组学的多组学联合研究smORFs编码的小肽越来越多。今天主要以一篇2017年发表文献,来看看作者如何利用相关技术研究LncRNA编码的功能性小肽。

研究背景
最近研究表明lncRNA也够编码短的蛋白(小肽),但相关研究比较碎片化,此外绝大多数小肽功能学未知。
研究思路
1、作者从肌肉功能相关差异表达的lncRNA组学数据入手,预测smORFs,推测差异基因编码的候选小肽发挥了生物学功能。
2、利用翻译组学技术证明候选lncRNA与核糖体翻译机器结合。
3、利用蛋白组学/多肽组学技术鉴定lncRNA编码的小肽。
4、最后通过质谱(MS/MS)、Flag knock-in、免疫学等功能学实验验证小肽的存在和生物学功能。
主要研究方法和结果
1. lncRNA-seq
通过RNA-seq技术可以发现大量的新转录本和isoform,再根据基因序列比对和保守性分析,利用相关软件如CPC,PhyloCSF和RNACode等可以对测序得到的转录本进行ORFs预测和蛋白编码潜力预测。本文中作者通过生信流程分析到lncRNA, LINC00961包含3个ORF,分别编码97 aa、33 aa和90 aa。Flag knock in和Immunoblotting证明只有ORF1能够编码一个90 aa的小肽。
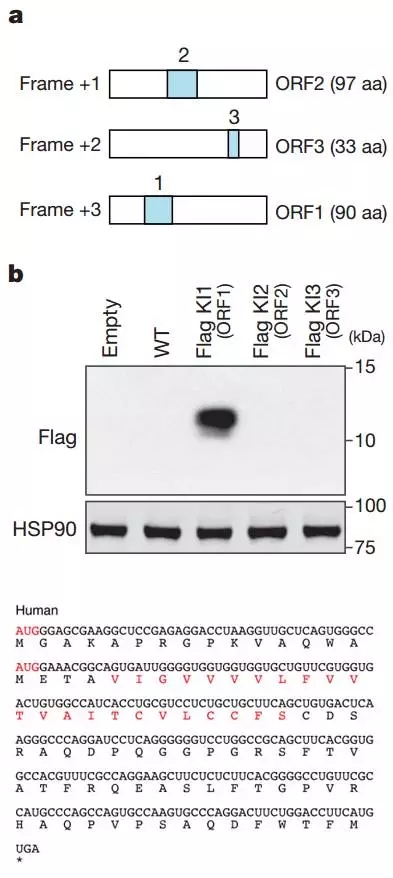
图1. a. 预测到LINC00961包含3个ORF(90 aa、97 aa和33 aa);b. Flag蛋白KI实验证明只有90 aa小肽能够表达;c. 90 aa smORF和氨基酸序列(红色高亮显示AUG codons和跨膜部分)
2. 翻译组学(translatome)
翻译组学技术包括多聚核糖体分析技术(polysome profiling)、翻译中mRNA(即RNC-mRNA)测序、核糖体亲和纯化技术(translating ribosome affiity purifiation, TRAP)、核糖体足迹谱技术(ribosome profiling)和翻译谱分析技术。
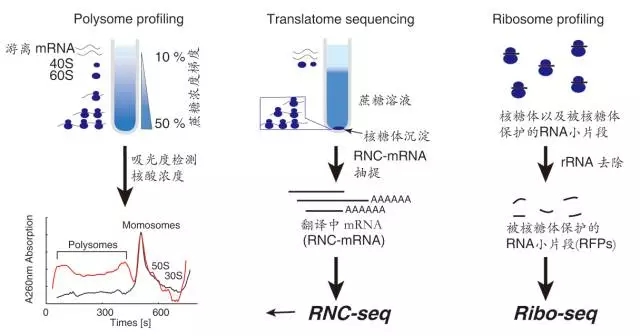
图2. 常用的翻译组学技术
本文中作者利用Polysome profiles,能够获取同一mRNA上的核糖体数量。一条mRNA上结合的核糖体越多,在蔗糖密度梯度离心时的沉降速率越快,因此结合不同数量核糖体的mRNA通过离心在溶液中会被分开,从而可以对结合有不同数量核糖体的组分进行分离。一般认为活跃翻译的mRNA通常结合着多个核糖体进行翻译,可以直观地反映细胞内翻译的状态。主要流程有:

作者利用蔗糖密度梯度离心40/60S subunit, monosome, di/trisome和polysome。再针对LINC00961设计PCR引物,证明LINC00961能够与翻译活跃的多核糖体复合物结合,具有翻译的潜力。

图3. qPCR检测分离组分中的HPRT、circHIPK3和LINC00961
3. 多肽组学(peptidome)
多肽类化合物是介于蛋白质组和代谢组这二者之间的、在生命过程起着极其重要作用的一类化合物。多肽组学的研究对象是在一个细胞或组织中所表达的所有内源性多肽类化合物。本文中作者利用LC–MS/MS进行分析一定范围细胞内的所有的多肽,主要流程有:

多肽组结果展示:
图4. 多肽组测到细胞中的小肽质谱(示例)
筛选到LINC00961-encoded的小肽,再用人工合成肽段,质谱检测准确度。
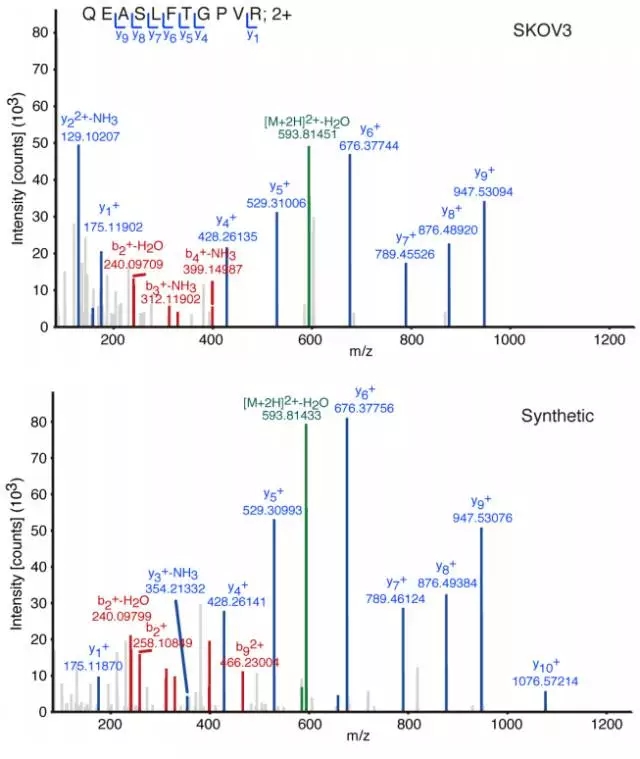
图5. SKOV3细胞裂解内源性小肽SPAR和合成肽段的质谱图谱
总 结
1、要进行lncRNA编码小肽的研究,可以先用转录组学技术拿到待研究的lncRNA序列数据,再利用生物信息学方法预测smORFs和uORFs,并预测其编码能力,并建立一个小肽candidate pool;
2、可以利用翻译组学研究哪些lncRNA能够与翻译机器结合,或者针对某个候选lncRNA进行qPCR验证;
3、再利用蛋白组学或多肽组学检测生物体内所有的内源性小肽,再与转录组和翻译组数据进行比对,证明候选lncRNA可以编码小肽;
4、最后,作为一篇《Nature》文章,本文除了通过多组学找到能够编码的lncRNA,还进行了系统的功能学实验验证,如质谱(MS/MS)、Flag knock-in、免疫学实验。感兴趣的老师可以细看文章中的实验部分。
参考文献
[1] Matsumoto A, Pasut A, Matsumoto M, et al.(2017). mTORC1 and muscle regeneration are regulated by the LINC00961-encoded SPAR polypeptide. Nature 541(7636): 228-232.
更多的原创文章,可继续关注我们网站动态发布,同时关注基迪奥微信~扫一扫添加基迪奥好友~随时随地关注行业动态!