蛋白组+转录组:揭示乳腺癌药物治疗靶点 返回
二代测序技术(NGS)已广泛应用于临床实践,体细胞成药基因组变化的快速诊断为个体化癌症治疗提供了条件。然而,体细胞突变的信号和生物学效应在人类肿瘤样本中并没有确定,并且在大多数临床样本中并没有通过NGS检测到成药基因组的改变。全面的蛋白质组学分析提供了一个有效的方法,来验证基因组结果,比如发现可能的生物驱动因子,寻找针对性治疗策略等。

免疫缺陷小鼠中的人源性肿瘤组织异种移植(PDX)模型可以维持源病人肿瘤组织学和分子异质性,最近有研究确定了PDX和原发性肿瘤之间相似的蛋白表达谱。由于患者治疗的异质性,很难在肿瘤样本中将治疗和蛋白质组学研究结果建立联系。
利用PDX系统,研究试图揭示,针对个体患者,蛋白质组学是否比单独基因组分析能提供更有效的治疗假设和预测生物标记物。
因此,这种模拟人肿瘤特异性的模型对肿瘤临床前期评估、治疗和预后具有重要的转化意义,特别是对于肿瘤的个体化诊断和治疗具有不可代替的价值。
小知识:
人源性肿瘤组织异种移植(patient-derived xenografts,PDX)是指将患者的新鲜肿瘤组织处理后移植到免疫缺陷鼠上,依靠小鼠提供的微环境进行生长。PDX模型保持了源病人肿瘤的组织病理学特征和肿瘤遗传学特征,为肿瘤的生物学研究、诊断标志物的寻找和药物筛选提供了一个重要的体内模型。
研究材料
24例乳腺癌PDX模型,分别来自原发性或转移性乳腺癌肿瘤,其中10例basal,1例CLDN-low,9例luminal B及4例HER2阳性。
24个PDX模型进行蛋白质组学iTRAQ(Isotope Tagging for Relative and AbsoluteQuantitation)分析,利用lable-free定量(LFQ)对18个PDX模型进行验证和确定。
23个PDX模型进行DNA和RNA测序,并对一个样本进行Sanger测序分析热点突变。
研究思路

利用DNA-seq、RNA-seq、iTRAQ和LFQ,主要进行体细胞突变谱、拷贝数变异(CNV)、mRNA表达、蛋白表达、磷酸化修饰水平及位点分析。
研究结果
1、乳腺癌异种移植的蛋白组学分析
作者利用24个PDX模型进行全面的蛋白质基因组分析,检测了12个乳腺癌肿瘤样本和对应的PDXs中显著突变基因中的体细胞突变。结果表明,这些基因中大部分关键的体细胞突变被保留,验证了PDX模型的保真度。
RNA-seq数据确定了16209个基因的表达,iTRAQ则确定了并筛选了10069种蛋白和36609个磷酸化位点用于后续分析。iTRAQ和 LFQ数据在标准化后显示合理的相关性,表明这两种检测手段利用相同的PDX模型能够交叉验证蛋白组结果。
2、蛋白质基因组整合与比较
mRNA表达和蛋白质丰度之间的相关性分析结果显示,83.6%的基因表现出显著正相关。随后检测mRNA-蛋白相关性是否与特定的KEGG信号通路有关,结果表明,一些管家基因在两个组学中都表现出非常强的正相关性,其中谷胱甘肽代谢通路显著性最高。
进一步检测乳腺癌关键基因CNV、mRNA和蛋白质表达水平的相关性:EGFR,ERBB2(HER2),ESR1,GATA3,PGR,PIK3CA,AKT1 / 2/3,MTOR和TP53,在大多数样本中,CNV、mRNA和蛋白质的表达水平是一致的,并且关键基因的整体表达模式和临床亚型诊断也是一致的。

图1 PDX样本中蛋白质基因组相关性分析
3、人乳腺肿瘤和异种移植的蛋白质分型
为了探究蛋白质组亚型和磷酸化蛋白质组亚型,对iTRAQ结果的前436种不同表达的蛋白质进行聚类分析(标准差大于2),发现了两个不同的集群,一类包含所有basal和唯一的CLDN-low乳腺肿瘤(WHIM12),另一类包含所有luminal B和HER2-E乳腺肿瘤。
同时利用iTRAQ磷酸肽表达数据推断蛋白磷酸化亚型,也产生了两个主要的集群,将luminal B和basal亚型分隔开。

图2 乳腺癌PDX样本转录组学和蛋白质组学聚类
对TCGA人肿瘤的77个蛋白质组数据进行蛋白质分型的验证,分析结果和24个PDXs聚类的亚型类似。
为了寻找luminal B和basal亚型的定义标记,作者对各个亚型的PDXs进行差异表达分析,最终发现了一些在LFQ和iTRAQ中均差异表达的蛋白标记物,包括SPR、GSTP1和SERPINB5。
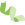
4、磷酸化图谱揭示肿瘤特异性激活的信号通路
利用KEGG信号通路中基因的蛋白质磷酸化图谱,寻找PDXs中肿瘤特异性激活的信号通路,结果显示,磷酸化富集分析确定了12个显著激活的信号通路,包括Ras、MAPK和NFκB通路。
一些已知的信号通路(如PI3K/AKT/MTOR)在大多数乳腺癌中被激活,但由于特异的基因组或蛋白组的改变,其他互补的肿瘤发生相关通路也在一小部分乳腺癌中被激活,如RAS/MAPK,显示出可替代的治疗机会。
除此之外,蛋白质磷酸化组分析揭示了不易被基因组数据预测到的的信号通路的激活。
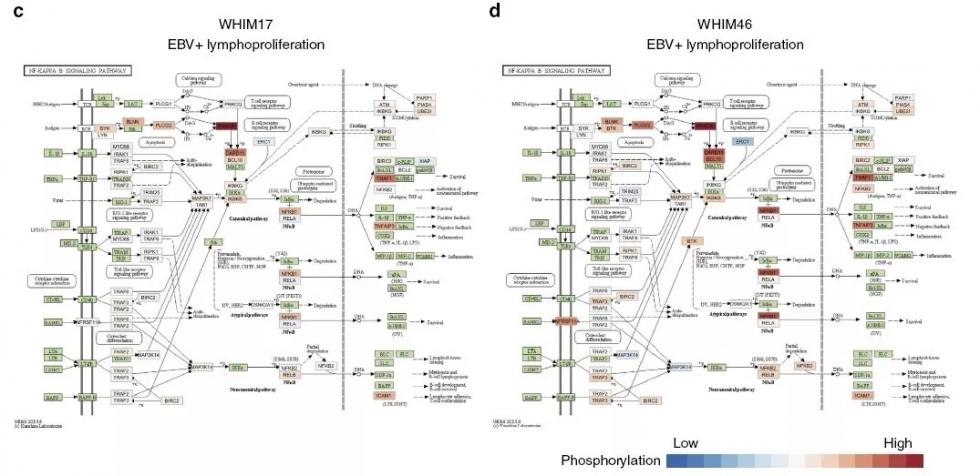
图3 磷酸化信号通路富集分析检测激活的信号通路
5、互补的基因组学/蛋白组学药物靶标
原癌基因的激活突变可以作为治疗靶标,同时异常过表达或活化蛋白产物也提供了可利用的治疗机会,比如HER2。因此,作者进一步寻找过表达基因/蛋白质或者具有高度磷酸化位点的蛋白质。
利用表达值四分位距(IQR)大于1.5筛选离群值,结果显示,mRNA和蛋白表达离群值显示出中度的正相关,但mRNA异常表达不保证蛋白的高表达。
相似地,部分磷酸化离群值也没有在蛋白水平检测到。因此,基于转录后和翻译后事件确定的潜在药物治疗需要同时考虑蛋白表达和基因表达。
蛋白质异常事件,如基因组驱动突变,在PDXs和人肿瘤中均观察到,一些蛋白质异常事件可能代表肿瘤发生的“蛋白驱动”,因此也可能是乳腺癌的潜在药物靶标。
图4 蛋白质基因组分析确定乳腺癌治疗靶标
6、利用乳腺癌异种移植模型进行靶向治疗
利用PDX模型进行靶向HER2和PI3K信号通路的药物治疗,研究结果显示,药物反应的程度可能与下游信号靶标有关,如AKT蛋白的过度和磷酸化。并且,PI3KCA在基因水平和AKTs在蛋白水平的双重激活可能是乳腺癌的共同特征。研究结果还显示出了利用对乳腺癌蛋白基因组特征进行组合治疗的可能性。
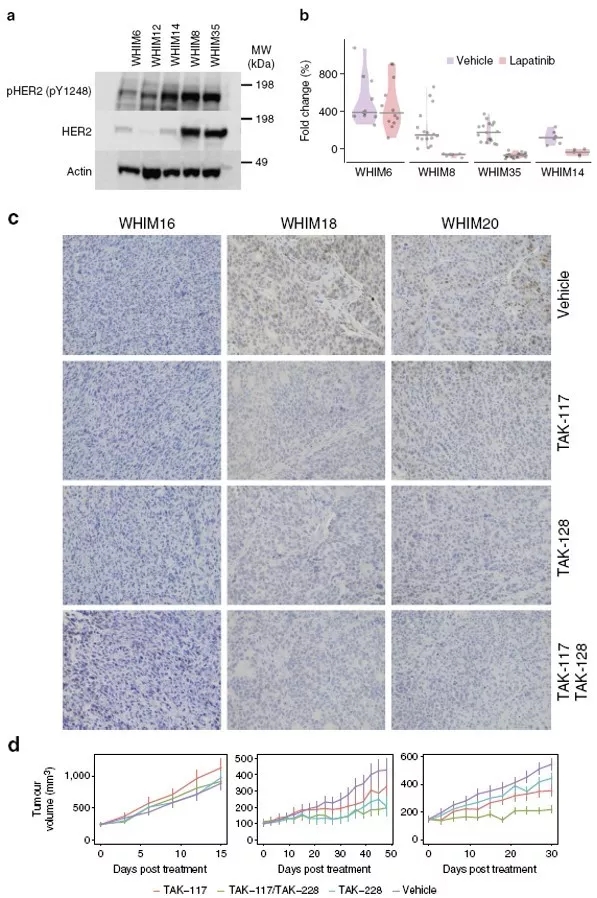
图5 乳腺癌异种移植的靶向治疗
小 结
1.利用PDX模型可获得与临床样本相似的结果,暗示了该模型应用于肿瘤治疗和研究的潜在价值。
2.将基因组和蛋白组进行整合分析,更精确地预测癌症变化机理,寻找癌症治疗靶标。
3.大多数药物作用靶标是蛋白,针对蛋白质组进行治疗药物筛选及药物应答效果预测比基因组更为有效。
参考文献:
Huang K, Li S, Mertins P, et al. Proteogenomic integration reveals therapeutic targets in breast cancer xenografts[J]. Nature communications, 2017, 8.
更多的原创文章,可继续关注我们网站动态发布,同时关注基迪奥微信~扫一扫添加基迪奥好友~随时随地关注行业动态!