基迪奥客户第9篇高分ncRNA编码研究文章,实力证明非编码可编码! 返回
lncRNA、circRNA等传统非编码RNA(noncoding RNA, ncRNA)已被大量证明具有翻译能力,同时ncRNA的编码研究也成为目前国际上最前沿的研究领域之一。翻译组是应用于ncRNA编码研究的关键技术,基迪奥生物提供的翻译组测序服务,已助力多位科学家成功解密ncRNA编码的生物学意义,帮助他们取得在此领域连续3年发表9篇10分以上高水平文章的成绩。
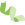
2021年3月4日,基迪奥合作客户中山大学附属第一医院的张弩教授,在《Nature cell biology》上发表“circRNA编码的致瘤性蛋白通过激活EGFR-STAT3信号通路促进胶质母细胞瘤的发生”一文。这已经是张弩教授团队和基迪奥合作发表的第9篇论证ncRNA可编码的文章,9篇均为高水平杂志文章,平均影响因子13+,实力证明circRNA和sORF可独立编码蛋白,调控关键信号通路,影响胶质母细胞瘤、乳腺癌等癌症的发生发展。
基迪奥合作客户ncRNA编码研究文章列表
之前周老师已经为大家解读和总结过多篇circRNA进行翻译组研究的文章和思路(链接:短短3年这个团队发了5篇环状RNA翻译文章 研究套路是怎样的?),在OmicShare在线课堂还详细介绍了研究套路,接下来我们将继续“跟着大牛学翻译”的节奏,学习非编码可编码的研究思路。

发表期刊:Nature cell biology
影响因子:20.042
发表时间:2021年3月
合作单位:中山大学附属第一医院
研究背景:胶质母细胞瘤(GBM)是常见的恶性肿瘤之一,激活的EGFR信号驱动了50%的肿瘤发生,但由于突变体的存在,靶向EGFR的治疗在某些患者中治疗无效,文章探究了参与EGFR信号通路中circRNA编码的蛋白的作用,意为治疗GBM提供新的思路。
测序策略:文章使用了转录组、翻译组、蛋白组等多个不同的组学技术
(1)发现目标环状RNA
对12例患者GBM癌及癌旁组织进行转录组circRNA-seq,对10例配对样本进行翻译组ribo-seq
(2)挖掘目标多肽调控的下游通路
两组细胞系和敲除株的转录组测序
(3)识别目标多肽结合的蛋白
Co-IP+蛋白质谱
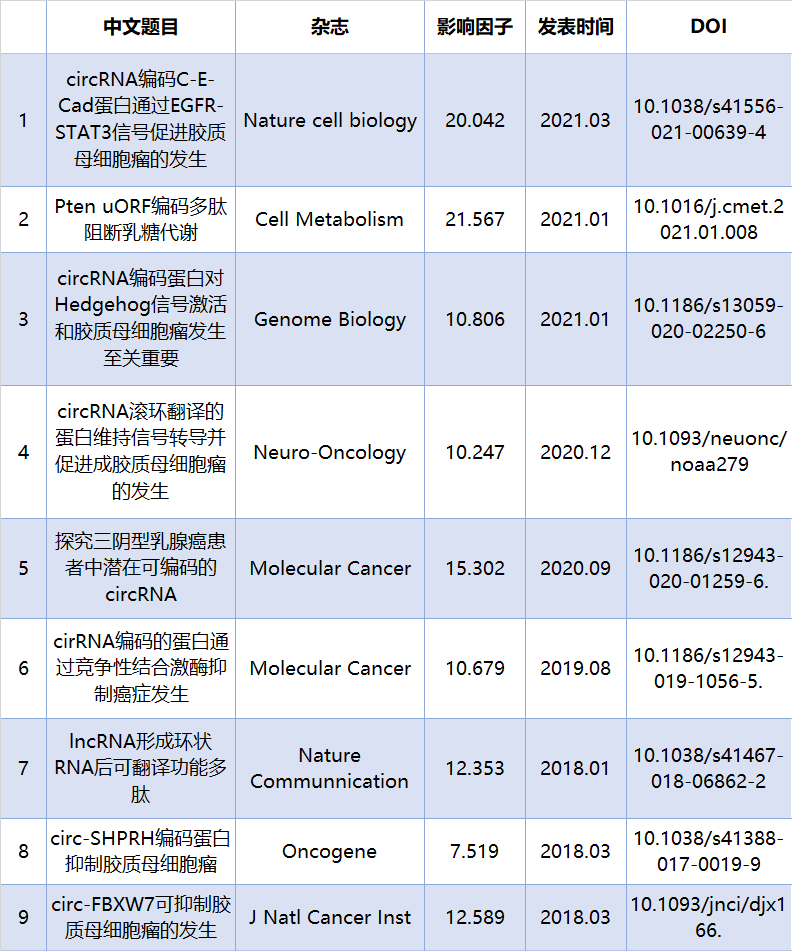
研究思路:
图1 文章研究思路
研究结果:
circ-E-cad RNA在GBM样本中显著表达
文章首先通过高通量测序找到在癌症和正常组织中明显差异表达的关键的可能编码蛋白的circRNA。
通过CircRNA-seq共鉴定到139,090个circRNA,用circBase注释到21,535个circRNA。通过差异分析,共得到2,289个差异circRNA(DEcRs)。通过Ribo-seq共鉴定到1,879个可能存在编码的circRNA,1,109个在circBase中有注释,有4个是已经有文章论述过。
为了排除偏倚的情况,作者用qPCR对患者来源的神经胶质瘤干细胞(GSCs)、神经干细胞(NSCs)、正常的星形胶质细胞(NHAs)验证了10个DEcRs。其中circ-E-Cad RNA是在GBM样本中最显著表达的circRNA之一,它是由上皮细胞标志物E-Cadherin基因的7-10个外显子构成的733nt的circRNA。
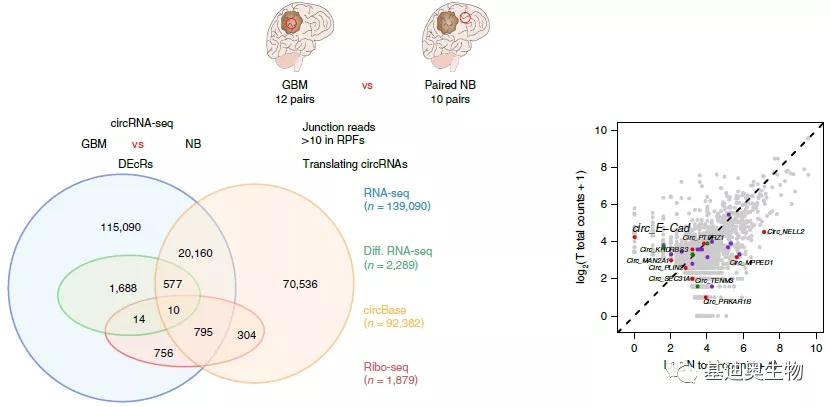
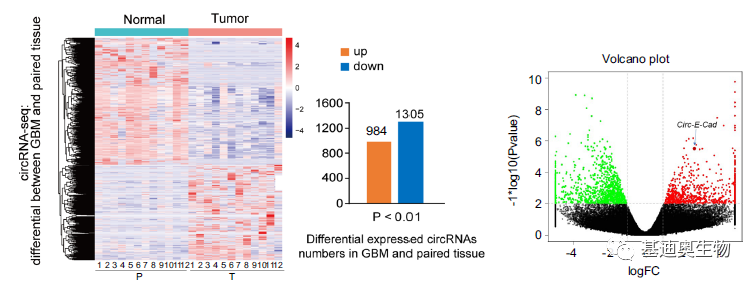
图2 CircRNA-seq和Ribo-seq鉴定结果
circ-E-Cad RNA可编码蛋白(C-E-Cad)
确定下了目标circRNA,下一步作者就对它的编码能力进行验证。作者在这一步通过单克隆抗体、质谱对circRNA编码的蛋白进行验证。
通过序列分析发现,circ-E-Cad的ORF跨过接口位点,编码254aa的序列,称为C-E-Cad,由于在第一圈翻译的时候缺少终止密码子,所以C-E-Cad在第二圈翻译的时候比正常的蛋白在羧基的位置多了14aa的尾巴。针对这一段14aa序列,作者构建了单克隆抗体,该抗体在过表达circ-e-cad RNA的gsch2s细胞中检测到28kda的特异性蛋白,在gsc387细胞中也检测到了内源性c-e-cad。这段14-aa的残基又通过质谱技术在GSCs中得到了验证。通过免疫组化和生存分析发现癌组织中C-E-Cad表达更高,高表达C-E-Cad的患者预后更不理想。
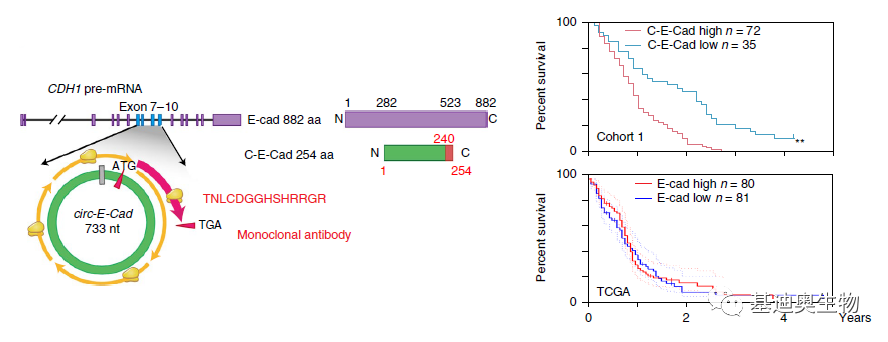
图3 circ-E-Cad通过滚环翻译编码蛋白
circRNA编码蛋白在肿瘤发展中的作用
确定了circRNA编码的特殊蛋白,作者通过干扰和过表达circRNA,结合生信分析,寻找蛋白参与调控的关键通路,确定分子机制,逐步细化确定蛋白在GBM发生中的作用。
①C-E-Cad可调控肿瘤细胞生物学特性和发展
结果发现,干扰circ-E-Cad后,C-E-Cad表达下调,过表达后,对应表达上调。干扰的C-E-Cad再表达后GSCs细胞恢复了生物学特性,促进了肿瘤的发展。
②C-E-Cad可激活肿瘤细胞中关键信号通路
为了了解C-E-Cad在GBM中的具体作用机制,作者利用RNA-seq数据对癌细胞和敲除circ-E-Cad的癌细胞进行富集分析,发现发生变化的基因参与的通路很多与恶性胶质瘤中的经典通路STAT3信号通路相关,还与PI3K-AKT,MAPK-ERK相关。通过GSEA分析也发现了相同的结果,受到STAT3调控的基因与癌细胞组呈正相关。为了排除circRNA母基因的影响,敲除E-Cadherin后回补,结果发现C-E-Cad与其功能相反,C-E-Cad会激活癌症相关信号通路。
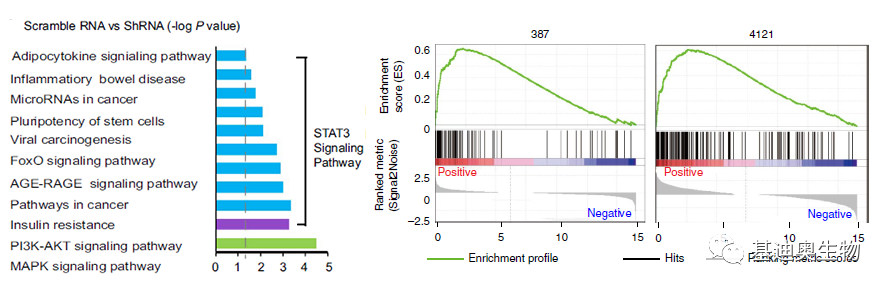
图4 富集分析和GSEA结果
③C-E-Cad可作为分泌蛋白激活EGFR
文章利用活细胞成像技术和标签抗体发现C-E-Cad能分泌到细胞外,促进细胞增殖、侵袭、抑制了细胞凋亡和衰老等。由于STAT3激活的主要分子途径包括EGFR,MET,PDGFA和IL-6R,分别对这些受体蛋白进行RNAi,发现EGFR干扰后,C-E-Cad不能显著激活STAT3,说明该蛋白主要通过EGFR激活STAT3通路。
Tips:
EGFR是上皮生长因子(EGF)细胞增殖和信号传导的受体,许多肿瘤中都存在EGFR高表达或异常表达。
④靶向C-E-Cad可增强抗EGFR家族药物治疗
接着,作者通过截短突变CO-IP实验发现,C-E-Cad通过在C端的14-aa残基与EGFR CR2结构域相结合。GBM中存在一种EGFR突变体,EGFRvIII,该突变体缺少胞外的EGF结合结构域,所以EGFR靶向药物无法有效发挥作用,而CO-IP实验发现C-E-Cad可以结合到这种突变体上,为抗EGFR抑制GSC肿瘤发生提供了新的思路。作者建立裸鼠脑胶质瘤细胞原位移植模型,分别用N_mab(以EGFR为靶点的单抗药物)和抗C-E-Cad抗体联合治疗,发现二者可协同抑制肿瘤的生长。
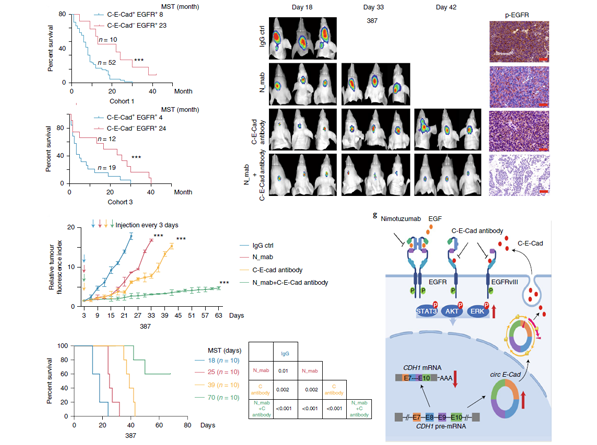
图5 C-E-Cad临床意义及应用
小结
1. 作者通过circRNA-seq找到circRNA,circ-E-Cad。通过Ribo-seq发现它能编码一种特殊的E-cadherin变体,一个254氨基酸的蛋白,C-E-Cad,与其来源的母基因编码的蛋白有相反的功能。在后续的实验中证明,C-E-Cad是一种新的能激活致瘤EGFR信号通路的配体,能影响肿瘤的发生,有作为靶向药物的潜力。
2. CircRNA中的开放阅读框(ORF)由于内部核糖体进入位点(IRES)的存在,使得原本不能翻译蛋白的circRNA也具备了编码的能力。结合已有文献,关注circRNA来源的明星基因,更容易找到有价值的circRNA。利用测序数据生信分析的结果,找到可能参与的典型的癌症相关的通路,通过分子实验的验证,能找到circRNA编码的蛋白具体的分子作用机制。再构建病理模型,可探讨其潜在的临床应用价值。
CircRNA可编码的能力研究思路在这些文章中已经形成模式,接下来我们还会解读相关文章,包括circRNA的滚环翻译特征,ORF可编码的研究等,继续帮助大家梳理和寻找ncRNA可编码的关键点。有对相关研究感兴趣的客户欢迎评论区留言或联系当地基迪奥销售进行咨询,为您提供行业领先的翻译组测序服务!