| 生物体内常见的蛋白质修饰包括磷酸化、糖基化、乙酰化、泛素化等,蛋白质修饰调节着蛋白质的活性状态、定位、折叠、功能以及蛋白之间的相互作用,在信号转导、细胞分化、细胞免疫、转录调控等多种细胞过程中发挥着重要作用。修饰蛋白组学是在蛋白修饰水平,对蛋白质修饰状态进行定性定量分析,获得不同处理或不同生理、病理状态下的蛋白修饰差异。 |
应用领域
|
细胞分化、细胞免疫等分子机制研究
疾病的发生发展机制
药物治疗机制
|
技术路线

分析内容
| 1. 标准信息分析 | 2. 定制化信息分析 |
|
a) 数据产出统计
b) 修饰蛋白数据库建立与搜索
c) 修饰蛋白质鉴定
d) 修饰蛋白质注释
e) 修饰蛋白质定量分析
f) 修饰蛋白差异表达分析
g) 差异修饰蛋白GO/KEGG功能富集分析
|
修饰肽段motif分析(部分物种可做)
|
样本要求
|
1. 新鲜动物组织:≥600mg
2. 新鲜植物组织:≥6g
3. 新鲜培养细胞:≥1×107个细胞每管,3管
4. 真菌、细菌:≥600mg
5. 血清、血浆:450μl × 4管
6. 体液样本:尿液:15ml ×4管(送样前需1000g离心5min,弃去沉淀),其他体液(唾液、羊水、细胞培养上清液等)要求15ml以上。
7. 蛋白溶液:蛋白总量5-10mg
#备注:乙酰化修饰送样量需按照以上要求的10倍来送。
|
项目周期
标准流程的运转周期约为50个工作日
参考文献
|
[1] Den Eynden J V, Umapathy G, Ashouri A, et al. Phosphoproteome and gene expression profiling of ALK inhibition in neuroblastoma cell lines reveals conserved oncogenic pathways[J]. Science Signaling, 2018, 11(557).
[2] Lao J P, Ulrich K M, Johnson J R, et al. The Yeast DNA Damage Checkpoint Kinase Rad53 Targets the Exoribonuclease, Xrn1[J]. G3: Genes, Genomes, Genetics, 2018
[3] Belczacka I, Pejchinovski M, Krochmal M, et al. Urinary Glycopeptide Analysis for the Investigation of Novel Biomarkers[J]. Proteomics Clinical Applications, 2018. |
|
泛素化介导花瓣衰老机制研究
|
合作单位:华南农业大学 发表期刊:《Plant Physiology》 影响因子IF:6.28 |
研究背景
| 衰老(凋谢)是一个非常复杂的过程,它在mRNA、蛋白以及翻译后修饰等多个水平受到调控,其中蛋白质大量降解是衰老的重要标记。泛素化修饰是一种重要的蛋白质翻译后修饰,它能够促进蛋白质降解,因此泛素化被认为与衰老有关。另一方面,已有研究表明,乙烯能够通过调节转录后修饰介导的蛋白降解参与到花瓣凋谢当中,但其机制还不明确。 |
实验取材
| 取16小时乙烯处理(实验组)和空气处理(对照组)各三个重复的花冠组织进行转录组测序、蛋白组以及泛素组质谱分析。 |
研究思路
| 文章主要通过蛋白组与泛素化组,辅助以转录组的方法开展研究(图1)。 |
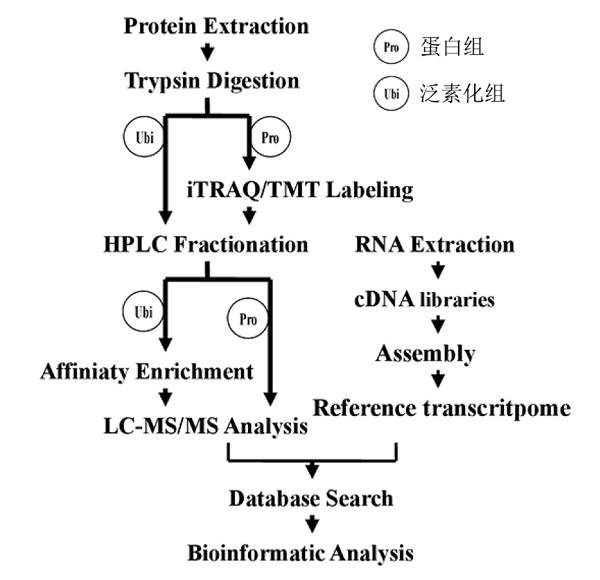
图1 文章研究思路
研究结果
|
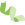
1.乙烯引起花瓣转录、蛋白和泛素化组改变 由于花瓣衰老在mRNA、蛋白以及翻译后修饰三个层面都有密切关系,因此作者分别通过转录组、蛋白组以及泛素化组同时研究乙烯对花瓣衰老的影响: 1)首先,在转录组层面,利用根茎叶花等八个组织构建参考基因组后,通过转录组测序分析发现16小时的乙烯处理引起花瓣的14448个基因表达下调,6303个基因表达上调。qRT-PCR验证了其中的基因(图2),KEGG注释表明这些差异基因主要与植物激素信号转导等22条通路相关。
|
图2 转录组与qRT-PCR检测差异表达基因情况 |
|
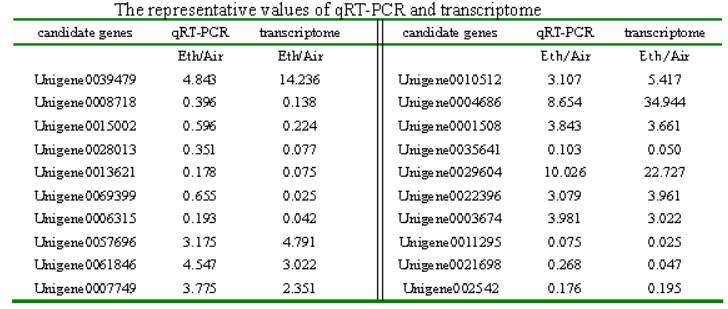
图3.具有差异Kub位点的蛋白功能注释 (A:上调、B:下调)和KEGG注释(C:上调、D:下调) |
2)然后,在蛋白水平,通过质谱分析发现了个3606个蛋白,其中上调的有233个、下调为284个。GO注释发现这些蛋白与杂环分解代谢过程等功能相关。 3)最后,在翻译后水平,也就是泛素化组(Ubiquitylome)进行研究。通过抗体富集以及质谱研究,精确地发现了2270个赖氨酸泛素化位点(Kub),其中乙烯处理后上调位点有320个,下调的则有127个。这些结果显示乙烯处理增加了花冠泛素化水平。KEGG注释表明这些正经历泛素化的蛋白参与到剪接体、RNA转运等多个通路当中(图3)。
|
|
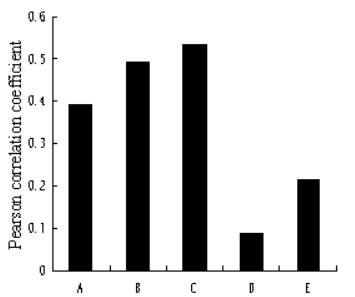
2.转录本数量与蛋白存在一定正相关性 以显著差异上、下调转录本为对象,对比对应的蛋白表达数据发现,上调转录本与对应蛋白存在一定相关性(r =0.49),而下调转录本则基本与蛋白数量难以产生联系(r=0.08)。同理,以显著上、下调蛋白为对象,对比对应转录本也发现上调部分有较高正相关(r=0.53),下调部分相关性较弱(r=0.21)。这可以预期到翻译后修饰有可能参与到蛋白调控当中,从而引起转录本与对应蛋白数量没有完全正相关。
|
图4 转录本与蛋白表达相关性 (A:所有差异转录本vs所有差异蛋白、B:上调转录本vs对应蛋白、C:下调转录本vs对应蛋白、D:上调蛋白vs对应转录本、E:下调蛋白vs对应转录本) |
|
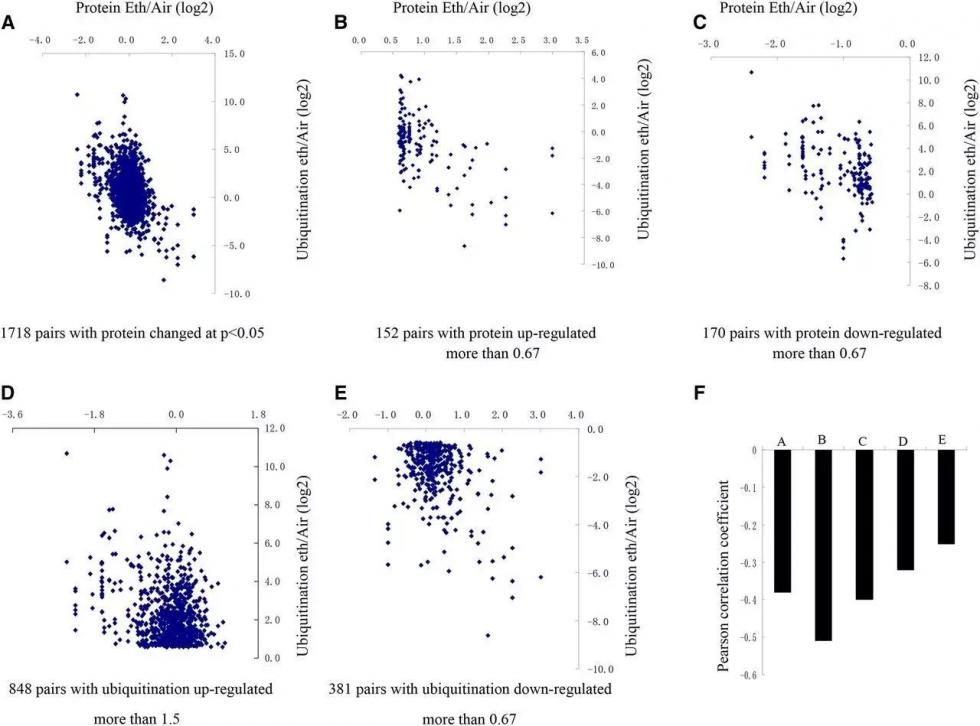
图5 总蛋白表达与泛素化位点蛋白相关性 (A:所有差异转录本vs所有具有泛素化位点差异蛋白(r=-0.38);B:上调蛋白vs对应泛素化位点(r=-0.51);C:下调蛋白vs对应泛素化位点(r=-0.4);D:上调位点vs对应蛋白(r=-0.32);E:下调位点vs对应蛋白(r=-0.25);F:整体统计) |
3.蛋白组与泛素化组存在负相关性 通过蛋白组与泛素化组的关联分析,可以发现存在泛素化位点的蛋白共有1121个,其中985个正在经历泛素化作用。通过对蛋白质总体表达水平和泛素化修饰蛋白数量进行比较,发现无论整体(图5A)还是从上下调的蛋白(图5 B、C)以及泛素化蛋白(图5D、E)开始进行比较,蛋白组与泛素化组之间存在负相关性。表示泛素化与蛋白降解有关。
|
|
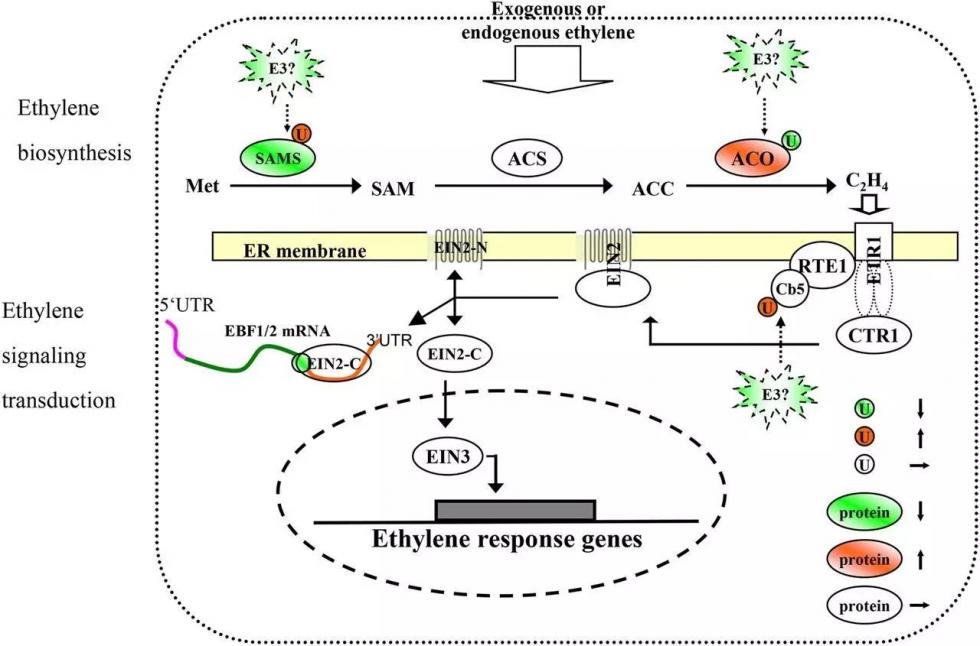
4.泛素化参与乙烯引起的蛋白降解 数据不单证明蛋白与泛素化位点成负相关,而且进一步发现,乙烯处理能够促进参与泛素化的蛋白的表达,从而引起蛋白大量降解。在转录组数据中,发现229个与泛素化相关的unigene在乙烯处理后发生上调。而蛋白组数据则发现4个蛋白在处理后发生上调。同时,在发生泛素化上调的蛋白当中,有44个的表达下调,只有8个上调。 5.乙烯通过多个途径引起花瓣凋谢 最后,综合转录组、蛋白组以及泛素化组的数据,作者详细地对乙烯引起花瓣凋谢的多条通路进行详细解释。发现了乙烯促进蔗糖合成和运输、阻碍苯环类以及苯丙脂类挥发性物质的合成、减缓氨基酸合成等。这些发现都有助于了解乙烯如何影响花瓣生命周期。
|
图6 乙烯影响乙烯生物合成和信号传导示意图 |
小结
|
本文结合转录组、蛋白组与泛素化多个组学,在mRNA水平、蛋白水平以及翻译后修饰水平深入研究花瓣的衰老机制。对大量衰老相关蛋白在衰老过程中泛素化修饰水平和蛋白质水平上的变化进行了重点分析,获得了大量新的蛋白质泛素化修饰位点,从蛋白质泛素化修饰这一角度对花瓣衰老进行了新的诠释。
|
|
参考文献:Guo J, Liu J, Wei Q, et al. Proteomes and Ubiquitylomes Analysis Reveals the Involvement of Ubiquitination in Protein Degradation in Petunias[J]. Plant Physiology, 2017, 173(1): 668-687. |