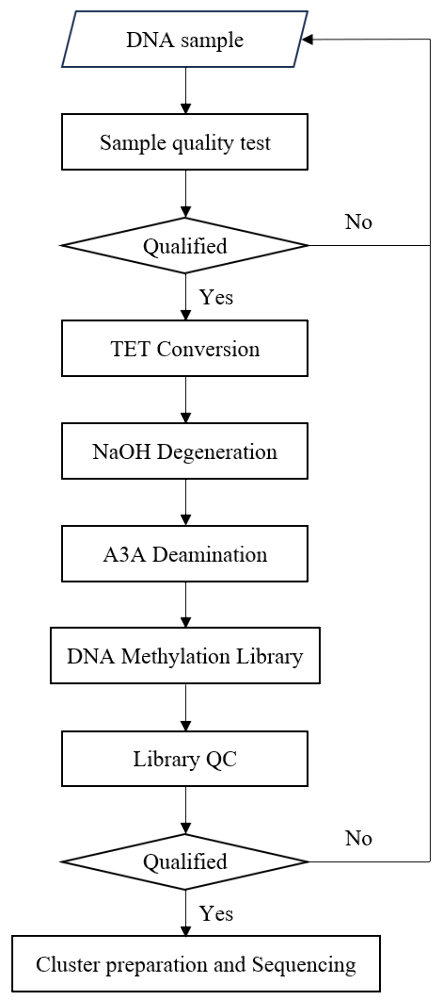
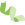
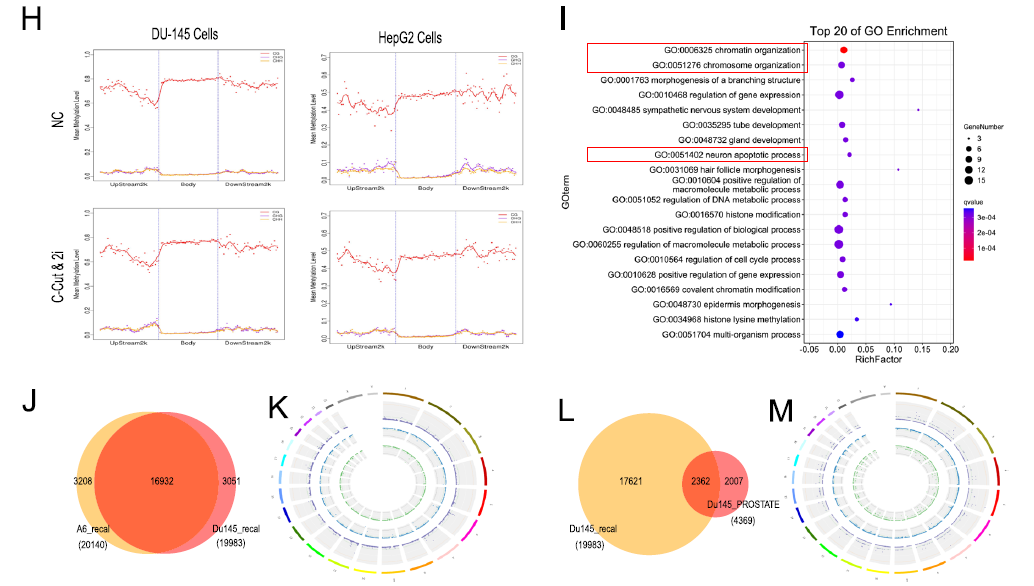
[2] Lister, Ryan, et al. "Human DNA methylomes at base resolution show widespread epigenomic differences." nature 462.7271 (2009): 315.
[3] Akalin, Altuna, et al. "methylKit: a comprehensive R package for the analysis of genome-wide DNA methylation profiles." Genome biology 13.10 (2012): R87.
[4] Wang, T., C.E. Loo and R.M. Kohli, Enzymatic approaches for profiling cytosine methylation and hydroxymethylation. Molecular Metabolism, 2022. 57: p. 101314.
[5] Hamaguchi, Y., et al., Identification of unique DNA methylation sites in Kabuki syndrome using whole genome bisulfite sequencing and targeted hybridization capture followed by enzymatic methylation sequencing. Journal of Human Genetics, 2022. 67(12): p. 711-720.
[6] Vaisvila, R., et al., Enzymatic methyl sequencing detects DNA methylation at single-base resolution from picograms of DNA. Genome research, 2021. 31(7): p. 1280-1289.
[7] Feng, S., et al., Efficient and accurate determination of genome-wide DNA methylation patterns in Arabidopsis thaliana with enzymatic methyl sequencing. Epigenetics & Chromatin, 2020. 13(1): p. 42.