|
Q: 空间转录组的样本保存建议?
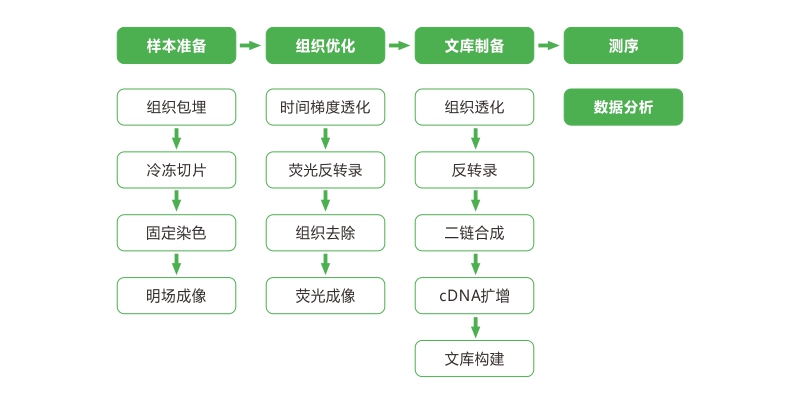
A:1)速冻后的样本放在异戊烷中,冻在-80℃;2)包埋后未切片的样本放在-80℃。包埋样本保存时注意密封,防止长期保存造成脱水。
Q: 空间转录组切片制备后,染色方法支持哪些?
A:HE染色(动物组织)和甲苯胺蓝染色(植物组织)。
Q: 空间转录组送样的时候,有什么注意事项?
A:1)组织冷冻过程中避免组织直接接触液氮,引起沸腾,导致速冻不均匀
2)异戊烷在液氮中放置不宜超过10min,否则异戊烷会凝固无法完成组织速冻
3)冷冻包埋盒先做标记,确定包埋盒中的样本名称,包埋后组织不可见,无法记录
4)组织放入包埋剂时建议目标切面朝下,方便后续切片时寻找目标切面
5)整个包埋过程避免气泡出现
6)保存时注意密封,避免组织脱水
Q: 空间转录组对测序深度的要求?
A:根据组织切片占捕获区域的比例计算测序量。计算测序量的时候,只需考虑被组织切片覆盖的spot,每个spot推荐最低起始测序量是5w PE read pairs。如果全覆盖,则数据量为5000×5w×300=75g。
Q:空间转录组需要几个生物学重复?
A:目前做空间转录组测序是可以不做生物学重复的,主要有两个原因。
首先,空间转录组技术现今还是新兴的技术之一,像转录组测序以及单细胞转录组测序等测序技术在刚出现的前几年也都是不要求做生物学重复的,算是新技术的一个红
利。
其次,空间转录组其实很难实现生物学重复。由于组织空间内部结构具有一定异质性(这也是空间转录组的研究对象),要求每个样本切片时的方位与深度等都一致,才能得到对应的生物学重复切片,这减少了生物学重复设置的意义。
说句题外话,关于连续切片的方式其实只是切片的技术重复,本质上还是在同一个组织样本上完成的切片样本收集,不能算作是生物学重复。
Q:单细胞+空间多组学,如何进行取样?
A:空间转录组实现了转录本所属组织的还原,但是,空间转录组的每个spot实际包含了1-50个细胞。通过空间转录组,我们只知道转录本在什么位置,而不知道每个位置由哪些细胞构成。我们可以将空间转录组的每个spot看作普通转录组的一个样本,利用单细胞转录组测得的每种细胞类型的表达量特征来推算每个spot潜在的细胞组分构成,从而将空间转录组图谱升级成空间细胞组成图谱。那关于两个组学技术的取样方式呢,也是有三种方案供大家选择。
第一种方案是在一开始样本收集的过程中,直接将样本一分为二。一份用于做空间转录组测序,另一份做单细胞测序。这个方案的优点是样本新鲜,单细胞悬液制备效果
好,提高了单细胞转录组数据的可靠性;不足之处是对样本需求量较高,同时,因为样本一分为二,可能会引起两组学关联性降低。
第二种方案是仅适用于空间转录组测序冷冻包埋方式的实验设计。可以在得到冷冻包埋样本后先进行空间转录组测序。将剩余样本置于液氮保存,等之后想做单细胞测序的时候再解冻样本,制备单细胞核悬液上机建库测序。相比之下,第二种方案获得的两组学数据同一性会更强,样本需求量会比较低,可以在空间转录组分析过程中有需求再增加单细胞测序,可调整性会更强;不足之处是单细胞测序只能使用核悬液,对包埋块保存要求较为严格,需尽可能减少水分挥发。
第三种方案则是仅做空间转录组测序,使用前人已发表的单细胞测序数据进行多组学联合分析。当然,这种方案也受限于已有对应物种、组织的公开单细胞测序数据,比起第一种方法来说虽然鉴定的可靠性没有那么多,但是可以省下单细胞测序的成本也未尝不是一种好方法.
总结一下,如果经费允许的话,可以选择前两种方案,数据可靠性强。如果空间转录组样本选用的是石蜡包埋样本则采取第一种方案,样本量较少或冷冻包埋样本可以选择第二种方案;如果经费有限,且相关的单细胞测序研究结果较多,那第三种方案可谓是性价比之王了。
Q:植物是否可以用于空间转录组?
A:理论上是可以的,植物也是可以通过mRNA的ployA结构进行捕获。
但一般不推荐做成熟组织,因为性价比较低。主要有两个方面:
第一,成熟组织液泡大,使得单个检测spot内的细胞数量极低,基因表达活性也不是很高,不利于后续的数据呈现;
第二,成熟的植物,比如成熟的茎,会有大量的导管和筛管,前者基本上都是死细胞,后者基本上都没有细胞核,很少有基因表达。而新生组织的细胞密度以及数据质量相比下来会更高,所以如果做植物的空间转录组的话,更推荐使用新生组织样本。
|