|
Q:10X 单细胞转录组与 smart-seq 技术的区别和优劣势在哪?影响 smart-seq 项目成功率的因素有哪些?
核心区别在于通量高低和研究内容不同,10×通量更高,smart-seq 可以做定量还可以做转录本结构分析。
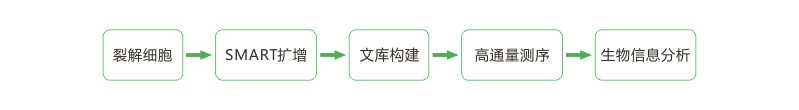
smart-seq 人鼠动物的案例都有涉及,成功率高低跟样本准备情况有关系。细胞分离之后,快速加入到准备好的裂解液中,这个步骤是成功率关键之一,另外,细胞收集当时的活性也是决定成功率因素之一。
Q:10X单细胞标记的细胞数目范围一般是多少?细胞标记上的数目是越多越好吗?还有捕获率偏低是什么原因?
A:标记效率官方是 65%,如果悬液质量比较好,活性高,杂质少,基本都可以达到这个效率,甚至比这个效率还高。
但实际上除了跟效率有关,还跟细胞数目计数准确性有关,因为细胞计数的时候,我们数的视野是很有限的,所以,细胞计数准确性不一定都能保证,所以也会造成标记效率的波动。标记上的细胞多,那么拿到的细胞肯定也多,但是也会有另一种问题,就是单个细胞的数据量少了,所以这里要做一定平衡。捕获率低跟悬液质量关系比较大,杂质,碎片这些往往捕获率低。
Q:单细胞测序需要做重复吗?如果做重复的话,是几个重复?
A:重复这问题可以参考普通转录组的演化历史。
首先一个基本逻辑,任何生物学实验都需要做重复的,这是第一点逻辑;第二审稿人也会考虑可执行性。以普通转录组为例,在 2010 年时,普通转录组非常昂贵,一个转录组好几万。那么审稿人也非常理解这一点,所以如果你不做重复的话,通常审稿人也不会太多质疑这一点;随着价格下降以后,审稿人默认大家能够承担这个实验成本了,一般就会要求做重复, 这是普通转录组的演化。即随着成本的不断下降,做重复慢慢的会作为要求多起来。
再说回单细胞,目前单细胞转录组发文章,一般不要求做重复,主要原因还是太贵。但从未来来说,可能随着价格下降,慢慢审稿人可能会要求做重复。
从单细胞测序做重复的必要性来说 ,还需要具体问题具体分析。如果只是关注基因表达, 做细胞的鉴定,然后挖掘一些目标 marker,然后做下游的验证。因为这个研究下的文章重点,其实还是需要有下游验证的。这种情况下不做重复,也没问题。
但如果文章很多结论都来自单细胞测序,那做重复会更可靠。比如关注的是细胞频率,即细胞的比例的变化。因为本身单细胞悬液制备过程中前处理、消化、制悬液以及细胞核的提取这中间其实是有误差的。如果不做重复,然后文章结论又说处理组相比对照组某个细胞比例下降了。其实这结论可能是成疑问了。当然如果单细胞测序没做重复,但后面用流式的方法,做细胞比例验证,那也可以的。
总结来说,做不做重复,还是要考虑成本以及文章的主要结论。推荐最好做 3 个。但考虑性价比的话,两个重复是性价比较高的策略。用最小的成本解决重复的问题。
Q:单细胞核测序优势
A:和单细胞测序相比,单细胞核测序的优势在于:
1)细胞核的大小远远小于原生质体细胞,这就避免因为原生质体悬液中有较大的细胞而放弃上机标记。
2)同时,细胞核提取的偏好性小于原生质体制备,能更好地代表整个组织中,真实的细胞类型组成。
3)而且单核提取过程避免了长时间对组织进行酶解消化,进而避免了对基因表达产生影响,可以获得更真实的基因表达情况。
4)有些研究可能需要跨越一个部位的不同生长发育时期,或者实验处理后不同时间点取样,整个周期可能较长,同一批次进行原生质体制备难度比较大,而细胞核制备的话,则可以把不同时期的样本,分别收集进行液氮速冻保存起来,之后同一批次进行单细胞核的制备和标记测序。
5)另外,如果使用细胞核进行单细胞测序研究,则可以应用转录组测序+ATAC 测序多组学联合标记,对每个核同时进行转录本信息以及染色质开放性信息捕获。
6)提取的细胞核,可以使用流式细胞分选等手段,去除大部分碎片杂质和次生代谢产物,获得高纯度的细胞核。
同时也要注意,对细胞核进行测序,细胞质中转录本信息就丢失了,获得的是核内转录本信息,核内的 mRNA 主要是正在加工的新合成 mRNA,并且其含量是少于胞质 mRNA 的。不过众多文献报道核 mRNA 和细胞总 mRNA 的相关性是很高的,分群效果是一致的。
Q:marker 基因怎么获得?
A:1)cellmarker:http://biocc.hrbmu.edu.cn/CellMarker/,包括人的 158 个组织 (亚组织)的 467
个细胞类型的 13,605 个 Marker 基因,和鼠的 81 个组织 (亚组织)的 389 个细胞类型的 9, 148 个 Marker 基因;
2)文献梳理;
3)亚群上调表达基因推测;
4)近缘物种的同源基因;
5)基迪奥公司积累数据库
|