宏基因组+代谢组 解码有机负荷率和消化物回流对厨房垃圾干式厌氧消化中抗生素和抗生素抗性基因发生规律的影响
|
合作单位:集美大学
发表期刊:Water Research
|
|
目的:探究有机负荷率(OLR)和消化液回流对厨房垃圾干式厌氧消化过程中抗生素和抗生素抗性基因(ARG)发生模式的影响,以及ARG传播的机制。
取材:使用120L水平推流式厌氧反应器,温度控制在39.0±1.0℃,搅拌速率为0.3rpm。使用厨房垃圾和花园垃圾作为发酵底物,并添加少量花园垃圾以维持进料总固体含量约为30%。实验分为四个阶段,分别控制不同的有机负荷率(OLR)和消化物回流比:P1(接种启动阶段):不控制OLR,时间为11天。P2(OLR逐步提升阶段):从2.0g·VS/L·d逐步提升到6.0g·VS/L·d,时间为91天。其中,第89-103天系统发生酸化,OLR提升停止。P3(停止进料阶段):停止进料12天,以缓解反应器中挥发性脂肪酸的积累。P4(OLR提升并回流消化物阶段):通过回流消化物的方式提升OLR,从5.0g·VS/L·d逐步提升到7.5g·VS/L·d,时间为249天。在每个阶段结束时取样,每个取样点取3个样品测定宏基因组与代谢组。
结果: OLR和消化液回流对反应器性能的影响:低OLR条件下,反应器稳定性高,但抗生素富集,抗生素抗性细菌(ARB)繁殖,例如假单胞菌和类杆菌。消化液回流可以提高OLR和甲烷产量,并降低抗生素和ARG的富集程度。
抗生素和ARG的变化:低OLR条件下,抗生素和ARG的丰度增加,这可能是由于ARB的增殖和抗生素选择性压力的增加。消化液回流降低了ARG和移动遗传元件(MGE)的丰度,从而降低了ARG水平基因转移(HGT)的风险。
ARB群落的变化:低OLR条件下,假单胞菌和类杆菌等ARB富集,而消化液回流则促进了梭菌和梭杆菌等能够降解复杂有机化合物的细菌的生长。 HPB和ARG的分布:在低OLR和系统不稳定的情况下,人源性致病菌(HPB)和相关ARG的丰度增加,这可能是由于VFAs和MGEs的积累。消化液回流可以减少HPB的丰度,并抑制ARG从功能性微生物转移到HPB。
ARG传播的机制:低OLR条件下,与ATP生成、氧化应激、EPS分泌和细胞膜通透性相关的功能基因丰度增加,这可能促进了ARG的HGT。消化液回流减少了ARG寄主、HPB、ARG和MGEs之间的联系,并抑制了相关功能基因,从而降低了ARG HGT的风险。
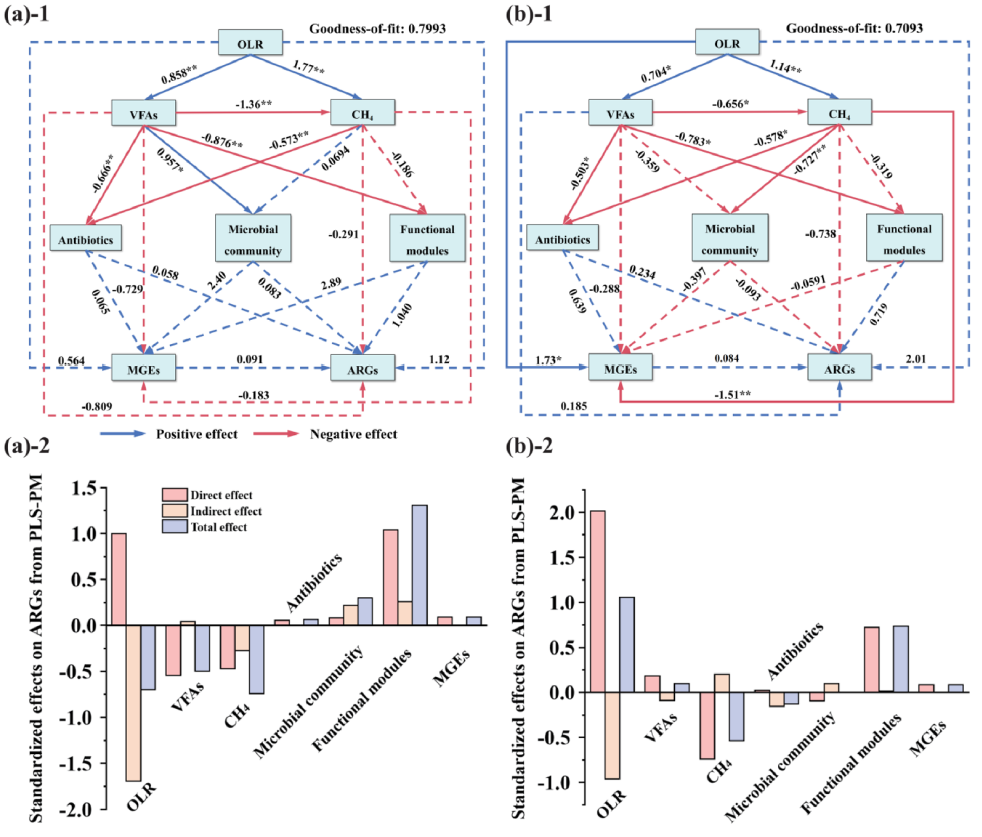
图1 PLS-PM分析揭示P2阶ARG富集程度
|
参考文献
| Li, Yanzeng, et al. "Deciphering the impact of organic loading rate and digestate recirculation on the occurrence patterns of antibiotics and antibiotic resistance genes in dry anaerobic digestion of kitchen waste." Water Research 261 (2024): 122005. |