|
10x Genomics单细胞免疫组库测序又称10x单细胞V(D)J测序,指通过特异性提取富集T/B细胞TCR/BCR区域RNA,通过比对、拼接、筛选、注释等构建免疫组库,分析得到TCR/BCR多样性序列,从而获得机体的免疫特征。
利用微流控芯片制备单细胞体系;选择5'端接头的通用引物和免疫分子恒定区的巢式引物进行V(D)J富集;实现成对的重链和轻链(B 细胞)或 α 和 β 链(T 细胞)的V(D)J测序。
|
|

分析内容
|
标准信息分析 (需提供参考基因序列、参考基因组序列及基因注释结果)
|
定制化信息分析 |
|
1. 测序数据统计与评估;
2. 比对与注释:样本基本信息结果统计、样本contig注释信息结果统计、样本consensus注释信息结果统计;
3. Clonotype分型;
4. 特征分析、CDR3特征分析、V/J基因特征分析、V-J paired特征分析;
5. 多样本分析:样本间Clonotypes比较、Overlapping Clonotype聚类分析、Overlapping Clonotype差异分析。
|
和10x Genomics 5’转录组关联分析。 |
|
样品要求/项目周期
请咨询当地销售或拨打电话:020-84889324、020-84889314了解详情。
|
|
[1]Azizi E, Carr A J, Plitas G, et al. Single-cell map of diverse immune phenotypes in the breast tumor microenvironment[J]. Cell, 2018, 174(5): 1293-1308. e36.
[2]Guo X, Zhang Y, Zheng L, et al. Global characterization of T cells in non-small-cell lung cancer by single-cell sequencing[J]. Nature Medicine, 2018, 24(7): 978.
[3]Zemmour D, Zilionis R, Kiner E, et al. Single-cell gene expression reveals a landscape of regulatory T cell phenotypes shaped by the TCR[J]. Nature immunology, 2018, 19(3): 291.
[4]Paulson K G, Voillet V, McAfee M S, et al. Acquired cancer resistance to combination immunotherapy from transcriptional loss of class I HLA[J]. Nature communications, 2018, 9(1): 3868.
|
|
胆管闭锁的致病机制和治疗方案
|
合作单位:广州市妇女儿童医疗中心 发表期刊:《cell》 影响因子:38.637 |
|
研究背景
胆管闭锁(biliary atresia, BA)是一种由肝外胆管阻塞介导的严重胆管病,在婴儿期可引起病理性黄疸和肝衰竭。因地域差异,发病率在1/5000-1/18000之间,不治疗会在一年出现肝衰竭。肝门吻合术是现在唯一的治疗手段,但术后依然有50%的患儿因为肝硬化而需要在两年内再次进行肝移植手术,且大多数伴有反复胆管炎、门静脉高压等并发症。
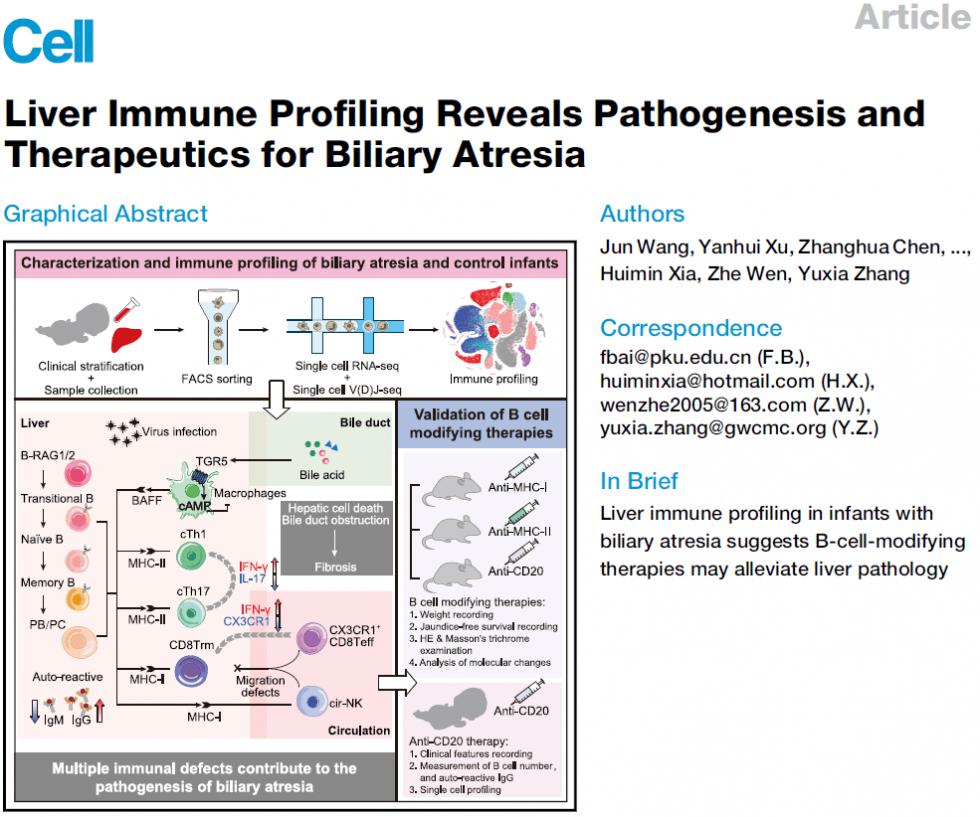
文章借助单细胞转录组和单细胞免疫组技术绘制了BA患儿的肝脏免疫细胞图谱,并从免疫的角度解释了BA的肝硬化和肝衰竭机制;在后续的一项探索性临床试验中,发现利妥昔单抗对BA患儿肝脏免疫环境恢复有积极作用。
研究思路
文章从6例BA患儿、6例囊肿癌变患儿和4例无黄疸对照儿童的组织活检样本进行单细胞转录组和单细胞免疫组测序,获得159622个免疫细胞的转录组数据,并划分为42个细胞群体。
研究结果
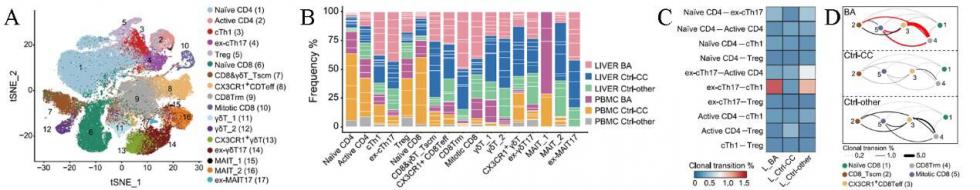
CD4+ T细胞的克隆型分析 可以看到ex-cTh17和cTh1的共享克隆型在BA患儿中明显升高,IFN-γ的表达量上升可能促进了Th17向Th1的转化。这一转化过程增加了CD4+ T细胞的细胞毒性作用。
CD8+ T细胞的亚群细胞数量显示,在BA患儿中,CD8Trm细胞数量增多而CX3CR1+ CD8Teff细胞减少,共享克隆型分析显示CX3CR1+CD8Teff细胞具备向CD8Trm细胞转化的能力;而免疫细胞的CX3CR1向肝脏星状细胞CX3CL1的募集和粘附又可以抑制细胞纤维化。所以,细胞毒性作用的上升和CX3CR1免疫细胞的减少促进了肝脏纤维化。
图1 T细胞图谱 A) T细胞分群tSNE图;B) 不同T细胞亚群在样本的细胞比例;C) 不同样本不同CD4+ T细胞亚群之间的共享克隆型比例; D) 不同样本不同CD8+ T细胞亚群之间的共享克隆型比例
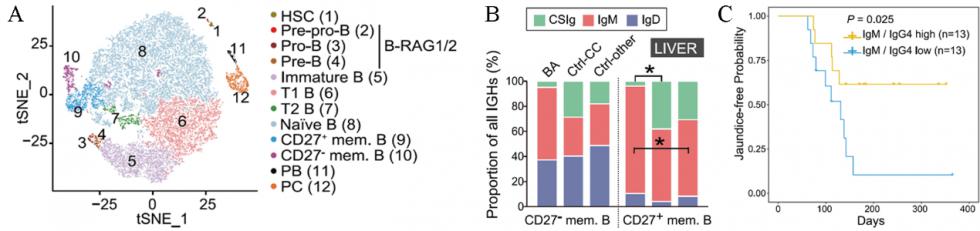
B细胞分析
(1)婴儿在出生后,肝脏依然具备生成B细胞的能力,表现为造血干细胞、pre-pro-B细胞至记忆B细胞、浆细胞一系的细胞的存在; (2)BA患儿肝脏的BCR具有自身免疫的特征,作者认为这是中枢耐受缺陷引起的,进而引起了肝脏损伤; (3)BA患儿肝脏的B细胞发生CSR(class switch recombination)的频率显著下降,使得具有保护性质的IgM浓度降低,具有杀伤作用的IgG浓度升高,这进一步诱发了肝脏损伤。 图2 B细胞图谱 A) T细胞分群tSNE图;B) 不同样本记忆B细胞的BCR类型频率统计图; C) 不同IgM/IgG比例患者的无黄疸生存曲线
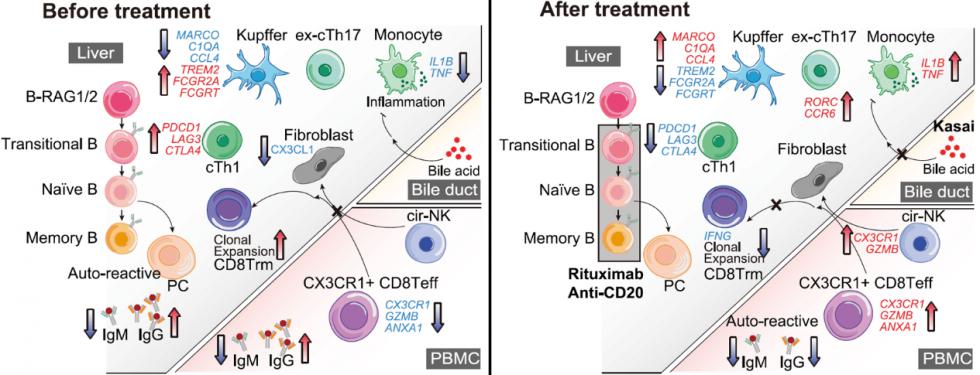
基于BA患儿的免疫细胞特征,作者认为B细胞修饰疗法可以缓解BA的肝损伤。在注射了利妥昔单抗(anti-CD20,清除成熟B细胞)后,患儿的肝脏免疫环境逐渐恢复为正常水平。
图3 利妥昔单抗治疗前后免疫微环境模式图
小结 从文章的结果我们可以看到多组学联用的优势,免疫组提供的克隆扩增信息锁定了关键的免疫细胞亚型,转录组提供的表达量信息确定了关键的作用分子,这种关联加速了BA分子机制的研究。
文章还采用了拟时分析来构建T细胞亚型之间的转化关系,转录因子分析来寻找B细胞亚型分化命运相关的转录因子,为T细胞介导的纤维化和B细胞介导的细胞损伤机制提供了更全面的机制解析。
从这篇cell我们可以看到,多组学和个性分析已经是现在单细胞测序的重要内容,无论对于加速分子机制研究还是提高文章档次都有裨益。基迪奥的服务模式可以很好地解决单细胞测序伴随的个性分析需求。单细胞悬液实验优化、分析方法定制、分析参数优化、数据专业解析、潜在亮点建议、论文框架建议、关键图表绘制、审稿意见回复是基迪奥提供的交互式个性化服务,为个性化要求高的单细胞测序保驾护航。
|