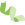
|
[1]. Buenrostro J D, Wu B, Litzenburger U M, et al. Single-cell chromatin accessibility reveals principles of regulatory variation[J]. Nature, 2015, 523(7561): 486.
[2]. Corces M R, Buenrostro J D, Wu B, et al. Lineage-specific and single-cell chromatin accessibility charts human hematopoiesis and leukemia evolution[J]. Nature genetics, 2016, 48(10): 1193.
[3]. Cusanovich D A, Hill A J, Aghamirzaie D, et al. A single-cell atlas of in vivo mammalian chromatin accessibility[J]. Cell, 2018, 174(5): 1309-1324. e18.
[4]. Mezger A, Klemm S, Mann I, et al. High-throughput chromatin accessibility profiling at single-cell resolution[J]. bioRxiv, 2018: 310284.
[5]. Buenrostro J D, Corces M R, Lareau C A, et al. Integrated single-cell analysis maps the continuous regulatory landscape of human hematopoietic differentiation[J]. Cell, 2018.
[6]. Lake B B, Chen S, Sos B C, et al. Integrative single-cell analysis of transcriptional and epigenetic states in the human adult brain[J]. Nature biotechnology, 2018, 36(1): 70.
|