lncRNA:一个全新的世界 返回
lncRNA:一个全新的世界
曾经,人们认为转录组主要由mRNA所组成,而高通量测序技术的发展和ENCODE项目为我们揭开了一个完全不同的世界。非编码RNA才是真正的主角。除了那些众所周知的RNA(如tRNA、rRNA),许多不同类型的调控RNA也进入我们的视线。
长链非编码RNA(lncRNA)是一类转录本长度超过200 nt的RNA分子,它们不编码蛋白。lncRNA的表达受到发育调控,是组织和细胞特异的。相当一部分lncRNA只位于细胞核内。它们包含许多类型的转录本,在结构上类似mRNA,有时也转录成编码基因的反义转录本。lncRNA被认为执行了重要的调控功能,也与疾病发展息息相关。
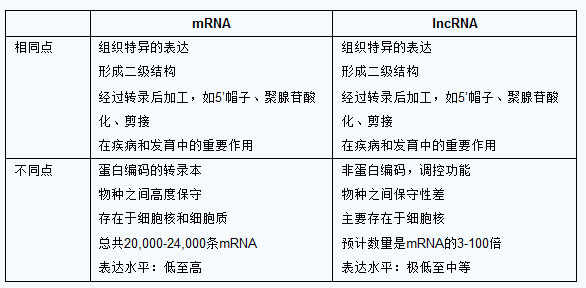
相同点组织特异的表达形成二级结构经过转录后加工,如5’帽子、聚腺苷酸化、剪接在疾病和发育中的重要作用组织特异的表达形成二级结构经过转录后加工,如5’帽子、聚腺苷酸化、剪接在疾病和发育中的重要作用。
不同点蛋白编码的转录本物种之间高度保守存在于细胞核和细胞质总共20,000-24,000条mRNA表达水平:低至高非蛋白编码,调控功能物种之间保守性差主要存在于细胞核预计数量是mRNA的3-100倍表达水平:极低至中等。
【1.1】lncRNA的功能
lncRNA可通过与DNA/RNA结合或与蛋白结合而行使其功能。一些lncRNA实际上是某些调控RNA(如microRNA或piwi RNA)的前体。与miRNA不同的是,lncRNA没有一种普遍的作用模式,它以许多不同的方式来调控基因表达和蛋白合成。研究发现,一些lncRNA参与了基因调控的基本过程,包括染色质修饰和结构以及直接的转录调控。基因调控可能以顺式(cis)或反式(trans)发生。lncRNA的转录后功能包括调控RNA加工事件,如剪接、编辑、定位、翻译和降解。
对于lncRNA在胚胎发育中的作用,Broad研究院的Mitchell Guttman曾这样描述,维持全能性的蛋白和促进分化的蛋白就像战士。它们各司其职,但需要一些东西来协调他们的行动。lincRNA则被认为是队长,带领不同蛋白,协同作战。
随着研究的深入,参与发育过程的lncRNA也不断被发现。据《Cell》杂志报道,麻省理工学院等机构的研究人员发现了一种新型的长链非编码RNA,称为勇敢的心(Braveheart,简称Bvht),它在哺乳动物发育过程,心血管发育谱系维持方面发挥了重要作用【1】。而Whitehead研究所的科学家也发现了10个在脂肪细胞发育中扮演重要角色的lncRNA。
最近人们试图根据lncRNA功能所涉及的分子机制来进行分类。据此,lncRNA可分为以下四种类型:
Signal archetype(信号原型):作为转录活性的分子信号或指示剂
Decoy archetype(诱饵原型):与其他调控RNA或蛋白结合并隔离
Guide archetype(指导原型):指导核糖核蛋白复合物定位到特定目标
Scaffold archetype(支架原型):作为相关分子元件(蛋白和/或RNA)组装的平台
【1.2】lncRNA与疾病
既然lncRNA有如此多的功能,那么它在疾病发生发展中发挥作用,也就不足为奇了。研究已发现lncRNA在多种癌症中差异表达,包括白血病、乳腺癌、肝癌、结肠癌和前列腺癌。lncRNA失调的其他疾病还包括心血管疾病、神经系统疾病和免疫介导的疾病。
近年来,lncRNA与疾病的相关性研究取得了很多进展。德国的研究人员发现了长链非编码RNA(MALAT1)促进肺癌转移的机制,并在《Cancer Research》杂志上发表了这一成果【2】。他们在体外培养的肺癌细胞中几乎完全沉默了MALAT1,发现它调节了许多与癌转移有关的基因。通过对MALAT1的阻断,他们有望开发出抑制癌转移的疗法。
第二军医大学的研究人员揭示了一种与肝癌微血管浸润相关的长链非编码RNA,以及其促进血管生成的分子机制。这一lncRNA或可作为肝切除术后患者无复发生存率不良的预测因子。该研究成果发表在著名肝脏疾病杂志《Hepatology》上【3】。之前,这一课题组的研究人员也曾发现lncRNA-HEIH在乙型肝炎病毒(HBV)导致的肝癌(HCC)发生中起重要作用。
【1.3】lncRNA数据库
lncRNA数据库对于lncRNA的研究也很关键。我们将在下一篇中具体介绍lncRNA相关的数据库。
既然lncRNA如此重要,相信很多研究人员都希望开展这方面的研究。至于如何研究lncRNA,且听下回分解。
参考文献:
1. Klattenhoff CA, Scheuermann JC, Surface LE, Bradley RK, et al. Braveheart, a long noncoding RNA required for cardiovascular lineage commitment. Cell 2013 152(3): 570-583.
2. Tony Gutschner, Monika Hämmerle, Moritz Eißmann, Jeff Hsu et al. The non-coding RNA MALAT1 is a critical regulator of the metastasis phenotype of lung cancer cells. Cancer Res 2012. PMID: 23243023
3. Sheng-Xian Yuan, Fu Yang, Yuan Yang, Qi-Fei Tao, et al. Long noncoding RNA associated with microvascular invasion in hepatocellular carcinoma promotes angiogenesis and serves as a predictor for hepatocellular carcinoma patients' poor recurrence-free survival after hepatectomy. Hepatology. 2012 Dec;56(6):2231-41.
——部分转载自生物通
LncRNA的研究方法
lncRNA(longnon-coding RNA)是一类转录本长度大于200nt的非编码RNA,最初被认为是基因组转录的“噪音”,通常伴随着mRNA协同转录,而转录水平往往低于mRNA,被当成是RNA聚合酶II转录的副产物。然而,近年来的研究表明,lncRNA能够通过多种方式发挥调控作用,参与了转录调控、组蛋白修饰、入核转运、染色体失活等过程,其转录和功能失调可能导致多种疾病的发生。它代表了基因组存在人类知之甚少的“暗物质”。鉴于其功能的重要性和多样性,越来越多的科研人员参与到对其的研究中来,引用BioTechnicques2013最新通讯上的话:"Longnoncoding RNAs(lncRNAs) are everywhere these days",各种高端杂志上发表了大量的综述性和研究性文章。
目前,对lncRNA功能的发掘1%都不到,而且发现新lncRNA的数量还在急剧增长,各种lncRNA的数据库诸如noncode,LncRNADisease等对lncRNA种类和功能进行收录和更新,而一些新的机制,比如ceRNA也在围绕lncRNA展开,可以看到,在这个领域的研究呈现出一幅如火如荼的场景。
LncRNA的作用机制不清楚,lncRNA的功能非常难研究。当前很多通过研究miRNA与lncRNA的调控关系来揭示非编码RNA的功能,热门研究之一是通过竞争性内源RNA(ceRNA)调控网络研究lncRNA的功能。通过已知作用机制的microRNA (它的sponge或ceRNA 效应)来推知相关lncRNA的功能,是lncRNA功能研究的新的方向和思路。
【2.1】相关的miRNA-lncRNA, ceRNA调控网络资源:
(1)starBase平台(http://starbase.sysu.edu.cn/mirLncRNA.php): 构建了最全面的CLIP-Seq实验支持的miRNA和lncRNA (包括了lncRNA,pseudogene, circRNA)的调控关系网络,构建了ceRNA调控网络和提供了长非编码RNA功能预测工具。
此外,starBase还构建了最全面的包含了14癌症类型(>6000个样本)Pan-Cancer(泛癌)表达图谱和互作网络。[Nucleic Acids Res. 2014 Jan;42:D92-7.]
starBase最新版已经发表在Nucleic Acids Res. (Li et al. 2014 Jan;42:D92-7.)上了,提供了最全面的CLIP-Seq数据支持的miRNA-lncRNA和ceRNA网络。starBase的第一版从2011年发表后,到目前被引用140多次(google scholar),访问10多万次,被选为ESI和Nucleic Acids Res.的Top Paper。只列出CLIP-Seq高通量实验数据支持的miRNA靶向的lncRNA。(由于单纯计算机预测的结果假阳性率非常高,故都不列出。
(2)DIANA-LncBase数据库(www.microrna.gr/LncBase)构建了基于单个CLIP-Seq数据和计算机预测的miRNA和lncRNA调控关系。[Nucleic Acids Res. 2013 Jan;41:D239-45.]
(3)miRcode:http://www.mircode.org/mircode/,瑞典哥德堡大学的研究人员开发的一种可以搜索的界面软件来预测miRNA的靶点,当前的版本覆盖了完整的GENECODE注释的转录组,包括10419条已经注册的lncRNA。
(4)linc2GO:http://www.bioinfo.tsinghua.edu.cn/~liuke/Linc2GO/index.html,清华大学整合的lncRNA功能注释数据库,以竞争性內源RNA(ceRNA)假说为基础的人的lincRNA功能注释。
【2.2】LncRNA的表达量研究方法
如果是想查看lncRNA在正常组织的表达图谱,可以查看ChIPBase上构建的人类22个正常组织/细胞系(基于RNA-Seq数据)的lncRNA的表达图谱 ( http://deepbase.sysu.edu.cn/chipbase/expression.php )。通过这表达图谱可以筛选感兴趣的组织特异或高表达的lncRNA。而且通过ChIPBase还可以查看这些组织特异表达的lncRNA是否受到特异的转录因子的调控(如:肝特异的,肌肉或心肌特异的,胚胎干细胞特异的,造血系统相关的转录因子等等)。
如果是特殊生理或病理时期的组织,查看相关文献是否有人报道了,能否直接使用报道的结果。如果没有文章报道,可能就要通过测序或芯片方法进行研究。如果想鉴定全新的特殊生理或病理时期的lncRNA,就需要进行RNA-Seq测序;如果只是想在已发现的lncRNA上,鉴定特殊生理或病理时期相关的lncRNA,用芯片的方法是可以接受的。
【2.3】高水平杂志的miRNA调控lncRNA的文章(协助确定研究思路与方法)
1. A long noncoding RNA controls muscle differentiation by functioning as a competing endogenous RNA. Cell. 2011 Oct 14;147(2):358-69
2. A coding-independent function of gene and pseudogene mRNAs regulates tumour biology. Nature. 2010 Jun 24;465(7301):1033-8.
3. A ceRNA hypothesis: the Rosetta Stone of a hidden RNA language? Cell. 2011 Aug 5;146(3):353-8.
4. Circular RNAs are a large class of animal RNAs with regulatory potency. Nature. 2013 Mar 21;495(7441):333-8.
5. Natural RNA circles function as efficient microRNA sponges.Nature. 2013 Mar 21;495(7441):384-8.
6. Endogenous miRNA sponge lincRNA-RoR regulates Oct4, Nanog, and Sox2 in human embryonic stem cell self-renewal. Dev Cell. 2013 Apr 15;25(1):69-80.
7. The Imprinted H19 LncRNA Antagonizes Let-7 MicroRNAs. Mol Cell. 2013 Oct 10;52(1):101-12.
8. The multilayered complexity of ceRNA crosstalk and competition. Nature. 2014 Jan 16;505(7483):344-52.
9. The STAT3-binding long noncoding RNA lnc-DC controls human dendritic cell differentiation. Science. 2014 Apr 18;344(6181):310-3.
以上内容转载自丁香园
http://www.dxy.cn/bbs/index.html
LncRNA研究
癌症与lncRNA研究最新及经典文献
【3.1】文献出处
Julia L, Anna P, etc. Regulation of pri-miRNA Processing by a Long Noncoding RNA Transcribed from an Ultraconserved Region.
谈到遗传物质,我们往往指的是从父母那儿继承到的DNA(脱氧核糖核酸)。这些DNA会转录成为RNA,进而指导各种蛋白质的合成,例如血红蛋白或胰岛素。除了这些RNA之外,细胞中还存在着大量神秘的非编码RNA。
MicroRNA是最广为人知的一种非编码RNA,这种微小的分子控制着众多基因的启动和关闭,是基因表达的重要管理者。日前,巴塞罗那大学Manel Esteller教授领导的研究团队发现,还有一种重要的非编码RNA监管着microRNA的活性。这项研究发表在Cell旗下的Molecular Cell杂志上,为人们展现了一个新型的ncRNA-ncRNA互作网络。
长非编码RNA(lncRNA)是长达两百个核苷酸以上的转录本,它们并不编码任何蛋白质。尽管如此,lncRNA在不同组织和发育阶段的表达依然具有特异性,这说明lncRNA的调控具有重要的生物学意义。
为何细胞不惜耗费能量对这些非编码RNA的表达和定位进行严格调控呢?这些RNA分子究竟有何功能?这些问题引起了科学家们的广泛关注,如今人们已经鉴定了大量lncRNA,不过这些只是冰山一角,大多数lncRNA的功能仍是未知的。
研究人员发现,长非编码RNA Uc.283+A控制着Pri-miRNA的加工,Pri-miRNA是microRNA基因的初级转录产物。这种lncRNA也被称为超保守RNA(ultra-conserved RNA),因为它的序列在进化中高度保守,从鸡到人没有出现任何变化。
“谁来监管细胞中的调控者呢?这个问题是我们展开研究的初衷,”Esteller介绍道。“我们知道,人类肿瘤缺乏超保守RNA Uc.283+A,这对于肿瘤的生长有促进作用,不过此前我们并不清楚其中的具体机制。这项研究显示,超保守RNA就像磁铁一样附着在另一种非编码RNA上,控制着它们的功能。这些超保守RNA就像是健康细胞中的高级督察,对调控者microRNA实施监管。如果细胞缺乏超保守RNA,microRNA就会受到影响,进而改变数以百计的基因表达,最终导致人体长出肿瘤。”
非编码序列也被称为基因组中的暗物质。如今,解码基因组暗物质已经成为了现代生物学中最激动人心的一个挑战。而这项研究有助于增进人们对它们的理解。
研究人员不仅为人们展示了调控miRNA生成的新型互作网络,也为癌症研究提供过了宝贵的新线索。
——转载自生物帮资讯
【3.2】文献出处:
Yang L, Lin C,etc. lncRNA-dependent mechanisms of androgen-receptor-regulated gene activation programs. Nature. 2013 Aug 29;500(7464):598-602.
人类基因组可生成1万多种长链非编码RNA(lncRNA)分子,但人们至今却只知道其中几十种转录物的功能。在2013年《自然》(Nature)杂志上的一篇新研究中,来自加州大学的杨柳青(Liuqing Yang,音译)等研究人员揭示,两种lncRNAs结合并控制了雄激素受体的功能。雄激素受体是一种可响应雄激素激活成千上万基因表达的转录因子。作者们发现抑制这两种lncRNAs可以阻止由于雄激素受体突变导致抵抗激素疗法的前列腺癌细胞的生长。
自上世纪40年代首次证实去势(castration)可以减慢前列腺癌进程以来,人们一直都认为雄激素信号是前列腺癌生长的主要推动力。因此雄激素剥夺疗法一直是晚期前列腺癌的主要疗法,并取得了很好的反应率。然而,大多数人的癌症都会在接受这种治疗2年内产生耐受。现在人们清楚地了解了,这种抵抗是由于各种机制重组性激素受体信号所致。
大部分的lncRNAs都与染色质调控因子相关,一些已知利用了调控相关基因表达的特异染色质标记物,对特定的染色体区域进行了“标记”。研究人员已经发现了若干前列腺癌特异性的lncRNAs,并证实一些与前列腺癌不同的亚型相关。2012年,美国食品和药品管理局(FDA)批准了利用lncRNA PCA3来检测前列腺癌。然而尽管发现了多种癌症相关lncRNAs,对于其中的大多数的功能仍然未知。
杨柳青等报告称,两种lncRNAs:PRNCR1和PCGEM1在许多侵袭性前列腺癌中高水平表达,增强了雄激素受体相关转录程序,促进了癌症生长。作者们利用ChIRP分析(近期开发的一种RNA定位方法),揭示出这些lncRNAs定位在染色体远端雄激素反应元件上,与雄激素受体共定位。在一连串惊人复杂的事件中,PRNCR1与雄激素受体的乙酰化C-末端发生了互作,招募DOT1L酶使得雄激素受体N端甲基化;这一步骤是PCGEM1随后结合雄激素受体的必要条件。然后PCGEM1与Pygo2发生了互作。
杨柳青及同事们进一步证实,PCGEM1和Pygo2促进了增强子序列和启动子序列“成环”,由此激活了雄激素受体靶基因。并且,不管是否存在雄激素,一种截短的活性雄激素受体也依赖这些lncRNAs。而抑制lncRNA可阻断雄激素依赖及非依赖性的癌细胞生长。如果在后续的研究中都能复制出这些结果,则表明lncRNAs可作为一种药物靶点,这将大大推动对抗晚期前列腺癌。
除了证实它们与前列腺癌相关,当前的研究结果还阐明了几个基础的分子机制。PRNCR1和PCGEM1强调了RNA与序列特异性DNA结合蛋白的一种新作用:改变转录因子活性。lncRNAs和转录因子之间相互联系可以编排对转录因子进行逐步的化学修饰,控制了信息从增强子连续流向靶基因激活。
这些研究结果还提供了关于lncRNAs介导增强子-启动子成环机制的认识。RNA介导招募一种对启动子相关组蛋白标记具有亲和力的蛋白质,至远端定位的增强子元件上可以稳定DNA成环,促进三维空间的沟通。这意味着不仅仅是简单的支架,lncRNAs更像是一个复杂的计算机电路板,将各种不同的分子元件连接到了一起,并指挥了系统的逻辑操作。
杨柳青和合作者在研究中还提出了很多的问题。例如,研究者们发现了一系列明显特异的RNA-蛋白质相互作用,它们的分子细节还有待进一步地调查。并且也还不清除是否已经确定了所有参与这些互作的元件,是否其他的类固醇激素受体或转录因子也以相似的机制发挥作用。
并且,目前也还不清楚PRNCR1和PCGEM1水平控制机制。作者们的数据表明,限定范围的PRNCR1和PCGEM1水平对于适当雄激素信号至关重要,但现在还不知道lncRNA生物合成以及这些RNAs水平增高的机制。近期的研究发现,在人类癌症中有许多的lncRNAs失调,了解这些转录物的生成和调控机制有可能在该领域研究中占据中心位置。
——转载自生物通